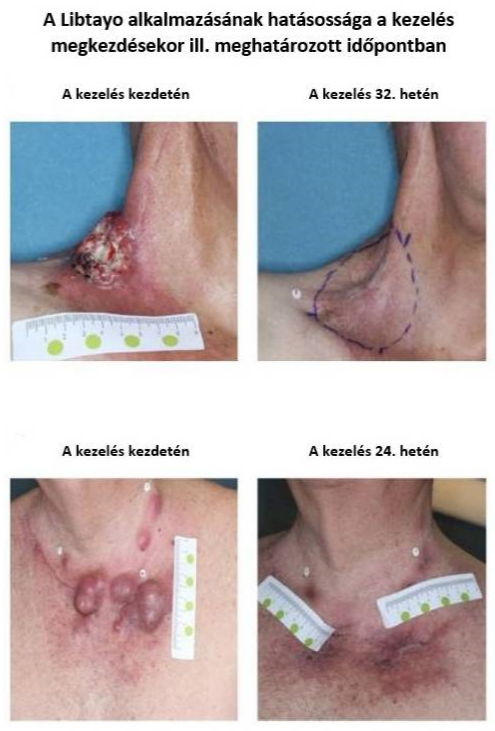
Jó hatásosságot mutat a Libtayo laphámsejtes bőrrákban – az EMPOWER‐CSCC‐1 vizsgálat új időközi eredményei
Új időközi eredményeket hoztak nyilvánosságra a fázis II EMPOWER‐CSCC‐1 vizsgálatban, melynek során a Libtayo (cemiplimab) klinikai hatásosságát értékelték.
Eredeti közlemény: New England Journal of Medicine (NEJM), 2018. július 26.
Update: Rischin D, et al. Poster 1318P. Presented at Maui Dermatology Conference 2020; January 25‐ 29; Maui, Hawaii;
Jelenleg a Sanofi‐Aventis és a Regeneron közös készítménye, a cemiplimab hatóanyagú Libtayo az egyetlen olyan szisztémás hatású szer, amely engedéllyel rendelkezik a bőr áttétes vagy lokálisan előrehaladott laphámsejtes karcinómájának kezelésére olyan esetekben, amikor a beteg műtéti vagy sugárkezelésre nem alkalmas. A Sanofi és a Regeneron még 2007‐ben kötött együttműködést antitestek fejlesztésére, ahol a Regeneron szabadalmaztatott VelocImmune® technológiáját használták fel. Az Egyesült Államokban az FDA 2017 szeptemberében már áttörést jelentő terápia (Breakthrough therapy) minősítést adott a készítménynek, 2018 áprilisában pedig elsőbbségi felülvizsgálatban (priority review) kezdték meg a gyógyszerjelölt értékelését, és a Libtayo 2018 szeptemberében forgalmazási engedélyt kapott a hatóságtól. A Regeneron és a Sanofi Genzyme Európában is megkezdte az engedélyeztetést: a Libtayo 2018 áprilisában került a vizsgálandó szerek listájára, majd a feltételes forgalmazási engedélyt 2019 júliusában kapta meg.
A bőr laphámsejtes karcinómájáról
A bőr laphámsejtes karcinómája (CSCC, cutaneous squamous cell carcinoma) a második leggyakrabban előforduló bőrráktípus, csak a bazálsejtes karcinóma incidenciája magasabb. A CSCC kialakulásának kockázati tényezői között szerepel a túlzott napfénynek való kitettség, a magasabb életkor, az ultraibolya sugárzásra érzékeny bőrtípus és az immunszuppresszió. A betegeknél a bőr felső rétegeinek sejtjei kontrollálatlan burjánzásba kezdenek, amelyet gyakran jellemeznek pikkelyes foltok, nyílt sebek, szemölcsök, valamint olyan kiemelkedő bőrképletek, melyek közepe mélyebben helyezkedik el, és kérgesedésre, vérzésre hajlamos. A betegek több mint 95%‐ánál sebészeti beavatkozást alkalmaznak, ám egyes esetekben a tumor ilyen eszközökkel már nem kezelhető, mivel áttétet képez, vagy olyan lokális progressziót mutat, hogy már sugárterápia sem alkalmazható. Amennyiben sem sebészeti, sem sugárterápia nem alkalmazható, eddig kizárólag a palliatív ellátás maradt, más eszköz nem állt rendelkezésre. Az Egyesült Államokban évente megközelítőleg 700 ezer új megbetegedést jelentnek, és becslések szerint körülbelül 3900‐8700 beteg veszti életét a betegség következtében.
A CSCC szisztémás immunterápiával kezelhetőnek tűnik: a mutációs teher (mutational burden) magas, és a betegség kialakulásának kockázata magasabb az immunszupprimált betegek körében – például szervátültetésen átesett betegeknél az alkalmazott immunszuppresszív terápia miatt a CSCC megjelenésének kockázata 65‐250‐szerese az átlagpopulációban mértnek. A legtöbb betegnél a tumorok hipermutációja következik be az ultraibolya fény okozta krónikus bőrkárosodás miatt. A magas mutációs terhelésű tumorok esetében nagyobb az esélye, hogy a betegek válaszolni fognak az ellenőrzőpont‐gátlókkal (checkpoint inhibitors) végzett immunterápiákra, ennek hátterében valószínűleg a tumorok jelentősebb neoantigén‐expressziója áll.
A cemiplimab hatóanyagról
A cemiplimab egy teljes egészében humán immunglobulin G4 (IgG4) monoklonális antitest, amelyet rekombináns DNS‐technológiával, kínai hörcsög ovárium sejtkultúrákban állítanak elő. A cemiplimab a programozott sejthalál receptor‐1‐hez (programmed cell death‐1, PD‐1) kötődik, és gátolja annak ligandjaival, a PD‐L1‐gyel és a PD‐L2‐vel való kölcsönhatást. A PD‐1 kölcsönhatása a ligandjaival, a PD‐L1‐gyel és a PD‐L2‐vel, amiket az antigénprezentáló sejtek expresszálnak és a tumor mikrokörnyezetben a tumor‐ és/vagy egyéb sejtek is expresszálhatnak, olyan T‐sejt funkciók gátlását eredményezi, mint a proliferáció, a citokinszekréció és a citotoxikus aktivitás. A cemiplimab a PD‐1‐nek a PD‐L1 és PD‐L2 ligandokhoz való kötődésének gátlásán keresztül fokozza a T‐sejt válaszokat, köztük a tumorellenes válaszokat is.
Klinikai vizsgálatok és vizsgált betegcsoportok, további fejlesztési program
Az FDA 2018 szeptemberében a fázis II EMPOWER‐CSCC‐1 (Study 1540) és egy fázis I (Study 1423) vizsgálat eredményei alapján adta ki a forgalmazási engedélyt; a fázis II vizsgálatban a későbbiek során összesen 193, (köztük 59 metasztatikus) beteg, míg a fázis I vizsgálatban 26 CSCC‐s beteg vett részt. A nyílt elrendezésű, multicentrikus fázis I vizsgálatba (NCT02383212) előrehaladott szolid tumorral diagnosztizált betegeket vontak be, fő célkitűzése a cemiplimab biztonságosságának és mellékhatás‐profiljának elemzése volt, így az elsődleges végpontok között a kezelés által kiváltott nemkívánatos események (TEAE, treatment emergent adverse events) és a normálistól eltérő laborértékek előfordulási arányának, valamint a dózislimitáló toxicitásokat (DLTs, dose limiting toxicities) mutató betegek számának meghatározása volt. A dózis‐eszkalációs vizsgálatokban a cemiplimab mély és tartós választ váltott ki CSCC‐ben szenvedő betegeknél, így került sor a fázis II EMPOWER‐CSCC‐1 vizsgálatra, ahol a készítmény klinikai hatásosságát több különböző betegcsoporton értékelték. Mindkét vizsgálat nyílt elrendezésű, multicentrikus, nem randomizált, több betegcsoportos vizsgálat volt, melyekből kizárták az autoimmun betegségben szenvedő betegeket, valamint azokat, akiket korábban már kezeltek valamilyen anti‐PD‐1/PD‐L1‐gátló antitesttel vagy egyéb immunellenőrzőpont‐gátló terápiával. A betegek a fázis I vizsgálatban 48 hétig, a fázis II vizsgálatban 96 hétig kéthetente kaptak 3 mg/kg cemiplimabot. A nem randomizált, pivotális, globális fázis II vizsgálatban az elsődleges végpont az objektív válaszarány (ORR, objective response rate) vagy a kezelést követően a tumorok zsugorodása ill. teljes eltűnése volt, egy további elemzéssel pedig a kontroll tartósságát mérték, amelyet azon betegek arányával fejeztek ki, akiknél legalább 105 napig nem jelentkezett progresszív betegség.
A fázis II EMPOWER‐CSCC‐1 vizsgálatban a betegeket kezdetben 2 csoportba sorolták: az 1. csoportba a nodális vagy távoli áttéttel rendelkező betegek kerültek, míg a 2. csoportban az irreszekábilis, lokálisan előrehaladott CSCC‐ben szenvedőket vizsgálták. Az európai engedélyeztetési folyamat részeként az EMA kifejezett kérésére egy 3. csoport kialakítására is sor került, ahová szintén a nodális vagy távoli áttéttel rendelkező betegek kerültek, ám ebben a csoportban az EMA javaslatára 3 hetente adagolták a Libtayo‐t (3 hetente 350 mg‐os dózisban). A közelmúltban egy újabb csoportot is meghatároztak, ám ebben a 4. csoportban még a betegek bevonása zajlik, itt a 4 hetente történő adagolást vizsgálják majd. A vizsgálat során a tumorválasz értékelése folyamatosan, 8 vagy 9 hetente történik az adagolási rendtől függően (2 ill. 3 hetente végzett adagolás). A metasztatikus CSCC‐ben szenvedő betegeknél, akiknél nem látható külső elváltozás, az ORR‐t a szolid tumorokra vonatkozó válaszértékelési kritériumok (Response Evaluation Criteria in Solid Tumours, RECIST 1.1) alapján határozzák meg. Külsőleg is látható léziók esetén (lokálisan előrehaladott CSCC vagy metasztatikus CSCC), az ORR‐t a radiológiai adatok (RECIST 1.1) és a digitális képek (digital medical photography, WHO kritériumok) független értékeléséből álló kompozit végpont alapján határozzák meg a betegeknél.
Eredmények
Az új időközi eredmények a 2019. július 9‐én lezárt cut‐off adatok, amelyek szerint a 3. csoportban az objektív válaszarány a korábban mértnél magasabbnak (39,3 helyett 41,1 %) mutatkozott – megjegyzendő, hogy az első három csoport esetében az ORR 49,2%, 43,6% ill. 41,1% volt, ami 95%‐os konfidencia intervallumot tekintve azt jelenti, hogy a betegek 28,1‐62,5%‐a fog reagálni a kezelésre. A válasz hat hónapon túli tartóssága is kiemelendő, mivel a 2. és 3. csoportnál 67,6 ill. 65,2%, az 1. csoport esetében pedig 93,1% volt. A legfrissebb cut‐off adatoknál módosítás történt az 1. betegcsoportban is, mivel az egyik beteg visszavonta beleegyező nyilatkozatát, így a 12 hónapos progressziómentes túlélés (PFS, progression‐free survival) ebben a csoportban 52,9%‐ra módosult, mag a 2. és 3. csoport 71,5 ill. 59,3%‐os értékeit ez nem befolyásolta. Ez a módosítás nem volt hatással a 12 hónapos teljes túlélés (OS, overall survival) adatokra is, mely a három csoport esetében sorrendben 81,3, 93,2 ill. 76,1% volt. A két klinikai vizsgálatban a kezelést a betegek 7 ill. 8%‐ánál kellett felfüggeszteni súlyos mellékhatások jelentkezése miatt, ám a leggyakrabban jelentkező mellékhatások (hasmenés, kimerültség, émelygés, székrekedés, kiütések, köhögés, étvágytalanság, viszketésérzet és fejfájás) általában grade 1‐2 súlyosságúak voltak, másrészt nem jelentkezett korábban ismeretlen, a PD‐1 gátlóknál még nem tapasztalt mellékhatás.
Következtetések
Az eredmények szerint előrehaladott CSCC‐ben a cemiplimab kezelésre a betegek közel 45%‐a (44,6%) mutatott választ, mely tartósnak is bizonyult mind az áttétes, mind a lokálisan előrehaladott betegségben szenvedőknél, a tapasztalt mellékhatásprofil pedig megegyezett a más PD‐1 gátlók alkalmazása során jelentettekkel. Tekintettel arra, hogy a hosszú távú hatásosságról és túlélésről egészen pontos adatok még nem állhatnak rendelkezésre minden kezelési csoport vonatkozásában – ilyenek például a válasz tartóssága (DOR), a teljes túlélés (OS) és a progressziómentes túlélés (PFS) adatai – nagy érdeklődésre tartanak számot az újonnan megjelenő köztes elemzések adatai.
A cikkreferátum alapjául szolgáló közlemények:
PD‐1 Blockade with Cemiplimab in Advanced Cutaneous Squamous‐Cell Carcinoma. N Engl J Med. 2018 Jun 4;379:341‐51. DOI: 10.1056/NEJMoa1805131.
Rischin D, et al. Poster 1318P. Presented at Maui Dermatology Conference 2020; January 25‐29; Maui, Hawaii;
Felhasznált források:
Libtayo (cemiplimab‐rwlc) for the Treatment of CSCC
PD‐1 in Patients With Advanced Basal Cell Carcinoma Who Experienced Progression of Disease on Hedgehog Pathway Inhibitor Therapy, or Were Intolerant of Prior Hedgehog Pathway Inhibitor Therapy
Bővebb információért olvassa el az alkalmazási előírást:
Libtayo alkalmazási előirat letöltése
Prof. Dr. Liszkay Gabriella Ph.D., med habil bőrgyógyász, klinikai onkológus kommentárja
A cikkhez tartozó kreditpontos kvízt itt töltheti ki.