Az atópiás dermatitisz
Az atópiás dermatitisz az egyik leggyakoribb krónikus, gyulladásos bőrbetegség. A közlemény célja a betegség patomechanizmusával, diagnosztikájával, terápiájával kapcsolatos ismeretek, újdonságok összefoglalása.
 Az atópiás dermatitisz (AD) az ekcémák csoportjába tartozó, krónikus gyulladásos bőrbetegség, mely a gyermekek akár 15–20%-át, a felnőttek 10%-át is érintheti.
Az atópiás dermatitisz (AD) az ekcémák csoportjába tartozó, krónikus gyulladásos bőrbetegség, mely a gyermekek akár 15–20%-át, a felnőttek 10%-át is érintheti.
Patomechanizmus
Az AD kialakulásában két fő tényező játszik szerepet: a bőr barrier károsodása és az immunrendszer eltérései. Mindkét károsodás bekövetkezhet genetikai és/vagy szerzett okokból.
A bőr barrier egyik legfontosabb feladata szervezetünk belső tereinek elhatárolása a külső környezettől. Ezenkívül megakadályozza különböző kórokozók (baktériumok, gombák, vírusok), kémiai hatások (allergének, toxikus vegyületek), fizikai hatások (mechanikai sérülés, UV sugárzás) bejutását a szervezetbe, valamint szabályozza testünk vízvesztését is.
A bőr barriert felépítő bármely struktúrfehérje genetikai vagy szerzett károsodása hozzájárulhat a betegség kialakulásához, azonban az egyik legismertebb ezek közül a filaggrin (FLG) fehérje hiánya. Az FLG génjében bekövetkező funkcióvesztő mutációk nagyon erősen prediszponálnak az AD kialakulására. Tudjuk, hogy a fehérje csökkent termelését okozhatja az AD-re jellemző bőrgyulladás is, vagyis szerzetten is kialakulhat.
Bármely úton jöjjön is létre az FLG hiánya, nemcsak a barrier károsodik emiatt, hanem egyéb következményei is lesznek. Többek között magasabb lesz a bőrfelszín pH-ja is, ami kedvez patogén baktériumok, pl. a Staphylococcus aureus kolonizációjának, de egyes bőrben található enzimek aktivitását is növeli, melyek elősegítik a T-sejtek által mediált gyulladás erősödését. Emellett FLG-hiányos betegek körében megnő az asztma kialakulásának esélye is, hiszen a károsodott barrieren keresztül az allergének könnyebben szenzitizálják szervezetünket.1
A barrier károsodásán kívül a veleszületett és szerzett immunsejtek működésének eltérése is kimutatható AD-ben. A keratinociták által termelt citokin, a thymic stromal lymphopoietin (TSLP) kulcsszereppel bír az AD-re jellemző bőrgyulladás kialakulásában. Számos környezeti trigger (mechanikai sérülés, S. aureus membrán, lipoproteinek) hatására termelődik, mely aktiválja a veleszületett immunitás sejtjeit (dendritikus sejtek, természetes ölősejtek, hízósejtek). A TSLP által aktivált dendritikus sejtek pedig a naiv T-sejtek T helper 2 (Th2) sejtekké való differenciálódását segítik elő. A Th2 sejtek olyan citokineket (IL-4, IL-13) kezdenek termelni, amelyek tovább károsítják a bőr barriert. A bőrben Th2/Th22 típusú immunválasz mutatható ki AD-ben, valamint kisebb számban Th1 és Th17 sejtek is detektálhatók. Ez a T-sejt-mintázat mind a betegség akut, mind a krónikus fázisában jellemző, a korábban leírt T-sejt-váltás (Th2-ről Th1-re krónikus fázisban) ma már nem elfogadott elképzelés.2
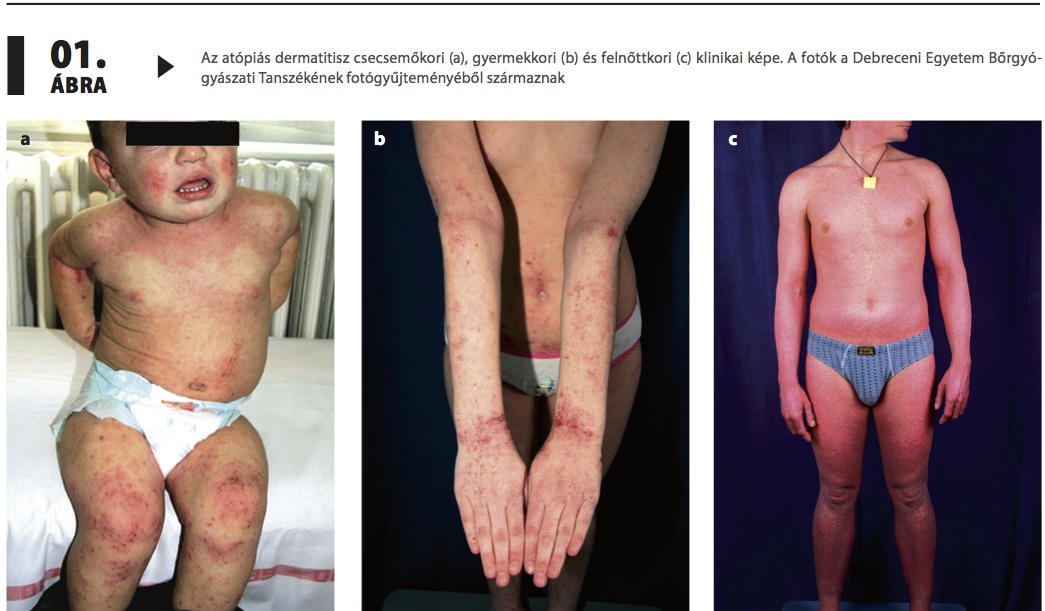
Az AD-nek három klinikai szakaszát különítik el: a csecsemőkori, a gyermekkori és a felnőttkori fázist. Mindegyik fázisnak típusos jeleit és lokalizációit különböztetjük meg, de átfedések is lehetségesek.3
A csecsemőkori formát eritémás, nedvező plakkok jellemzik, melyek főként az orcákon jelennek meg, gyakran az egész arc, valamint a hajas fejbőr is érintett. Amennyiben a tünetek kiterjedtek, érinthetik a törzset, a végtagok feszítő felszínét és a farpofákat is (1.a ábra). Gyermekkorban már kevésbé jellemzők az exszudatív tünetek, inkább a bőrszárazság, lichenifikált papulák és plakkok láthatók. A tünetek jellegzetes lokalizációban jelennek meg, a kézfejen, lábfejen, csuklón, könyökhajlatban, térdhajlatban. Az arcon inkább a periorbitális és periorális érintettség a jellemző (1.b ábra).
A felnőttkori AD prevalenciája a fejlett országokban ma már a 15–30%-ot is elérheti, így a néhány évtizeddel ezelőtt csak gyermekkori, kinőhető betegségnek gondolt AD-re ma már élethossziglan fennálló betegségként tekintünk. A gyermekkoron túl is perzisztáló tünetekre számos tényező hajlamosíthat. A már kezdetektől is súlyos klinikai forma, az elsősorban nyakra-arcra lokalizált tünetek, az FLG-mutáció, a fényérzékeny bőrtípusok, atópiás betegség a családban, női nem, más atópiás betegségek (allergiás rinitisz, asthma bronchiale) az anamnézisben. Az öregedéssel kapcsolatos hormonális változások, az immunrendszer szeneszcenciája is befolyásolja a tünetek megjelenését.4
A felnőttkori AD klinikai formái jóval változatosabbak. A tünetek száraz, hámló eritémás papulákból, nagy, lichenifikált plakkokból állnak, de előfordulhatnak prurigós göbcsék is. Nedvezés, pörkösödés csak bakteriális felülfertőződés esetén alakul ki. A tünetek predilekciós helyei leginkább a fej, nyak, felső végtagok, hát, a kéz- és a lábfej dorzális felszíne (1.c ábra).
A betegség súlyossága a Scoring Atopic Dermatitis (SCORAD) meghatározásával állapítható meg. A SCORAD felosztható objektív és szubjektív részre. Az objektív részben hat tünet (eritéma, nedvezés/pörkösödés, lichenifikáció, exkoriáció, bőrszárazság, ödéma) intenzitását (0–3 pont) és kiterjedését (a 9-es szabály alapján) tartalmazza. A szubjektív rész a beteg által panaszolt viszketés és alváshiány mértékét (0–10 pont) méri. A maximális pontszám 103, 25 pont felett közepesen súlyos, 50 pont felett súlyos betegségről beszélünk.5
Diagnosztika
 Az AD diagnózisának felállítása mindig a klinikai kép alapján történik. A klinikai tünetek leírására ma is a Jon Hanifin és Rajka György által kidolgozott kritériumrendszert használják.6 Az eredeti kritériumrendszert revideálta az American Dermatological Association, így esszenciális tünet a viszketés, valamint az életkorra jellemző megjelenésű és lokalizációjú ekcéma (mindkettőnek teljesülnie kell), a fontos jellemzők közé pedig a korai kezdet, az egyéni és családi atópiás anamnézis, és a bőrszárazság tartozik. Járulékos jellemzők az arci sápadtság, pityriasis alba faciei, ichtiózis, tenyéri hiperlinearitás, keratosis pilaris, periorbitális elváltozások, fehér dermografizmus, lichenifikáció, exkoriáció jelenléte.7 A diagnózis felállításához fontos a pontos anamnézisfelvétel, melyhez az 1. táblázatban található kérdések segítséget jelenthetnek.8
Az AD diagnózisának felállítása mindig a klinikai kép alapján történik. A klinikai tünetek leírására ma is a Jon Hanifin és Rajka György által kidolgozott kritériumrendszert használják.6 Az eredeti kritériumrendszert revideálta az American Dermatological Association, így esszenciális tünet a viszketés, valamint az életkorra jellemző megjelenésű és lokalizációjú ekcéma (mindkettőnek teljesülnie kell), a fontos jellemzők közé pedig a korai kezdet, az egyéni és családi atópiás anamnézis, és a bőrszárazság tartozik. Járulékos jellemzők az arci sápadtság, pityriasis alba faciei, ichtiózis, tenyéri hiperlinearitás, keratosis pilaris, periorbitális elváltozások, fehér dermografizmus, lichenifikáció, exkoriáció jelenléte.7 A diagnózis felállításához fontos a pontos anamnézisfelvétel, melyhez az 1. táblázatban található kérdések segítséget jelenthetnek.8
A betegség súlyosságának vagy az allergiás szenzitizációnak a meghatározásához, a barriert ért károsodás mértékének vizsgálatához kiegészítő laboratóriumi vizsgálatokat (vérkép, szérum-laktát-dehidrogenáz, összes és specifikus IgE a szérumban), allergológiai vizsgálatokat (prick teszt, atópia patch teszt, epikután teszt), és bőrbarrier-vizsgálatokat (transzepidermális vízvesztés, FLG-mutáció, stratum corneum és szérum-TSLP meghatározása) végezhetünk. Fontos megemlíteni, hogy ezek a kiegészítő adatokat szolgáltató vizsgálatok nem szükségesek a diagnózis felállításához, a diagnózist a klinikai kép és az anamnézis alapján állítjuk fel.8
Differenciáldiagnosztika
Az AD diagnosztizálása a változatos klinikai megjelenés miatt olykor bőrgyógyász számára is kihívást jelent, hiszen sok más gyakori bőrbetegség merülhet fel a differenciáldiagnózisban.
A szeborreás dermatitiszt, főleg csecsemők esetében, sokszor nehéz elkülöníteni az AD-től. A csecsemőkori szeborreás dermatitisz a hajas fejbőrt, az arcot, az axilláris és az inguinális régiót érintheti. Az elkülönítést könnyíti, hogy kiterjedt szeborreás dermatitisz esetén a pelenka alatti terület is érintett lehet, míg AD-ben nem. AD-re jellegzetesek a száraz hámlással kísért, eritémás papulák, plakkok, míg szeborreás dermatitiszben inkább zsírosan hámló, lazacvörös papulák, plakkok jellemzők. Szeborreás dermatitisz esetén exkoriáció nyomait nem látjuk, mivel az érintett terület nem vagy csak enyhén viszket.3
A pszoriázis, mely leggyakrabban a 20– 30 és az 50–60 éves korosztályt érinti, de bármely életkorban előfordulhat, szintén hasonlíthat AD-re. A kontaktdermatitisz elemi jelenségei hasonlóak az AD-éihoz, azonban a tünetek éles széle, típusos elhelyezkedése, valamint az anamnézis segíthet a kórformák elkülönítésében. A rühesség, hasonlóan az AD-hez, eritémás, exkoriált papulákkal jár, a betegek kifejezett viszketésről panaszkodnak. Ilyenkor a rövid anamnézis, a lakótársak hasonló panaszai, az éjszaka erősödő viszketés, a tenyéri, talpi, genitális tünetek a szkábiesz diagnózisát erősítik meg.
A dermatitis herpetiformis Duhring, a gluténszenzitív enteropátia bőrmanifesztációja esetén is kifejezett viszketésről panaszkodnak a páciensek, a tünetek főleg a végtagok feszítő felszínén jelennek meg. A diagnózis felállításában a bőrbiopszia lehet segítségünkre. Ritkább kórképek, mint a hiper-IgE-szindróma vagy egyes genodermatózisok (pl. FLG-mutáció következtében kialakult ichtyosis vulgaris) is hasonló bőrtünetekkel járhatnak, mint az AD.8,9
Terápia
Lokális kezelés
Az AD bázisterápiáját az emolliensek jelentik. A bőrpuhító, bőrnyugtató kezelés javítja a bőr barrier funkcióját, fokozza a gyulladáscsökkentő lokális készítmények hatását, csökkenti a lokális kortikoszteroid iránti igényt, csökkenti a fellángolások számát. A hidratálókat legalább naponta kétszer kell alkalmazni. Az emolliensek tartalmazhatnak vazelint, glicerint, ureát. Az ureáról fontos megjegyezni, hogy irritációt okozhat, ezért gyermekek esetében háttérbe szorult a használata, inkább a glicerint tartalmazó externákat javasolják. Irritatív hatású lehet gyermekek esetében a propilénglikol, valamint egyéb allergizáló hatású növényi fehérjék (pl. mogyoró, zab, búzakivonat) használata is.
A bőr tisztítása is kulcsfontosságú. Langyos, 27–30 °C-os vízben való 5 perces fürdés, az utolsó 2 percében fürdőolaj hozzáadásával, segít megakadályozni a bőr kiszáradását. A tisztálkodáshoz szappan és tusfürdők helyett jobb szintetikus detergenseket használni, emolliens fürdőolajokkal.
Az emollienskezeléssel együtt a lokális gyulladáscsökkentők használata az AD terápiájának fő eszköze. A lokális kortikoszteroidok nemcsak akut fellángoláskor hatásosak, hanem segítenek a tünetmentes periódusban is, a fellángolások megelőzésében. Erősség alapján négy csoportot különítünk el: enyhe (I), közepesen erős (II), potens (III) és szuperpotens (IV) szereket. Akut fellángolás esetén potens szerek napi egyszeri alkalmazását ajánljuk 3–6 napig. Enyhe betegségaktivitás esetén elegendő a heti 2-3-szori alkalmazás megfelelő bázisterápiával. A lokális szteroid alkalmazásának mértékegysége az ujjhegy egység (fingertip unit). Egy egység az az 5 mm-es tubusnyíláson át kinyomható mennyiség, amely a mutatóujj tenyéri, disztális végpercének redőjétől az ujjbegyig ér. Egy egységnyi szteroiddal egy felnőtt a testének kb. 2%- át tudja bekenni. Nedvező, erodált tünetek esetén kezdetben hígított szteroidokkal átitatott nedves pakolást, kötést célszerű alkalmazni pár napig, legfeljebb 2 hétig. Régebben a gyulladás szanálódásával a lokális szteroid készítményt is leállították. Ma már a proaktív szemléletet fogadjuk el, vagyis a leggyakrabban érintett bőrrégiókban kis dózisú gyulladáscsökkentő kezelés alkalmazását javasoljuk hetenként kétszer.10
A lokális gyulladáscsökkentő szerek másik csoportja a kalcineurininhibitoroké. A tacrolimus és a pimecrolimus tartozik ide. Hosszú távon alkalmazva gyorsan csökkentik az akut tüneteket, csökkentik a fellángolások számát, hosszú időn keresztül tünetmentességet biztosíthatnak. A kalcineuringátlók használatakor nem alakulnak ki a kortikoszteroidokra jellemző mellékhatások, ezért ez a kezelés az olyan érzékeny bőrterületeken is alkalmazható, mint az arc, a genitáliák, a lágyékhajlat, a hónalj. A leggyakrabban jelentkező mellékhatás a csípő érzés, viszketés, kipirulás az alkalmazás helyén, de ezek pár napos használat után elmúlnak. Tacrolimus-kezelés során a S. aureus kolonizációjának csökkenését írták le. Használata mellett nem volt gyakoribb az eczema herpeticum kialakulása sem. Az FDA 2005-ben „fekete doboz” figyelmeztetést adott ki a kalcineurininhibitorokra vonatkozóan, mivel szervátültetésen átesett betegek körében, szisztémás használat mellett megnövekedett számban észleltek limfoproliferatív betegségeket. Nagy betegszámú, hosszú távú vizsgálatok azonban ezt nem támasztották alá, lokálisan alkalmazva hosszabb távon is alig mérhető volt a szérumszintjük11 (2. táblázat).

Szisztémás kezelés
Súlyos, kiterjedt, lokális kezelésre nem reagáló betegségben szisztémás kezelést is be kell állítani. A szisztémás szteroid hatékonyan és gyorsan tudja csökkenteni a tüneteket, azonban csak rövid ideig, megfelelő dózisban alkalmazható. A ciklosporin hosszú távú szisztémás kezelés beállításakor választandó szer, melyet viszonylag kisebb dózisban (2,5–3 mg/ttkg, max. 5 mg/ttkg) alkalmazunk. Fontos a betegek vesefunkciójának gyakori ellenőrzése, valamint a rendszeres vérnyomás-ellenőrzés a gyógyszer szedése alatt. A methotrexat szintén hosszú távon alkalmazható immunszuppresszív szer, szintén kis dózisban (10–20 mg/hét) adható, megfelelő folsavpótlással. Szedése alatt fontos a vérkép, a májenzimek rendszeres ellenőrzése. Amennyiben hatástalanok azathioprin vagy mycophenolat-mofetil adásával is próbálkozhatunk.
Habár kisszámú és változó eredményű kutatás áll rendelkezésre, az allergénspecifikus immunterápia, ha nem is első vonalbeli terápiaként, de megpróbálható. Szenzitizált AD-betegek bőrtünetei fellángolhatnak az adott allergénnel való találkozás után. Az allergénspecifikus immunterápia az adott allergénre kialakuló szenzitizációt szünteti meg. Azokban az esetekben, amikor egyidejűleg rinitisz vagy asztma is fennáll, a légúti tünetek is csökkenthetők.
AD esetében is várhatók a biológiai terápiák a jövőben középsúlyos, súlyos betegség fennállásakor. Remélhetőleg egyedi méltányossági kérelemmel hamarosan elérhető lesz majd az interleukin-4-receptor-α-gátló dupilumab. Az IL-31-gátló nemolizumab a viszketés csökkentésében lehet jó hatásfokú, egyelőre az 1. fázisú vizsgálatai fejeződtek be. Az anti-TSLP tezepelumabot szintén 1. klinikai fázisban vizsgálják. A biológiai terápiák megjelenésével súlyos AD-ben szenvedő betegek számára nyílnak hatékonyabb kezelési lehetőségek.1,12
Összegzés
Ma már egyre több információnk van az AD patomechanizmusával kapcsolatban, köszönhetően a világszerte ezzel foglalkozó számos kutatásnak. Ezek eredményeként jelentek meg a közelmúltban új kezelési elvek, terápiák, és a jövőben is egyre betegségspecifikusabb, célzott terápiák válnak majd elérhetővé.
A munka elvégzéséhez az OTKA K108421, a GINOP-2.3.2-15-2016-00050 és az EFOP-3.6.1- 16-2016-00022 projektek nyújtottak segítséget. Utóbbiak az Európai Unió támogatásával, az Európai Regionális Fejlesztési Alap társfinanszírozásával valósultak meg.
Levelezési cím: This e-mail address is being protected from spambots. You need JavaScript enabled to view it.
A szerzők munkahelye:
Dr. Hajdu Krisztina,1 Ványai Beatrix,2 Katona Melinda,3 Dr. Szegedi Andrea4
1Szakorvosjelölt, 2orvostanhallgató, 3PhD-hallgató, 4PhD, tanszékvezető egyetemi tanár, Debreceni Egyetem, Bőrgyógyászati Tanszék és Bőrgyógyászati Allergológiai Tanszék
Irodalom:
1. Hajdu K, Szegedi A. Az atópiás dermatitis patomechanizmusa. Bőrgyógy Vener Szle 2017;93:195–201
2. Brunner PM, Guttman-Yassky E, Leung DY. The immunology of atopic dermatitis and its reversibility with broad-spectrum and targeted therapies. J Allergy Clin Immunol 2017;139:65–76
3. Nagy G. Az atópiás dermatitis klinikai jellemzői gyermekkorban. Bőrgyógy Vener Szle 2017;93:209–216
4. Pónyai Gy. A felnőttkori atópiás dermatitis: epidemiológia, provokáló faktorok és prognózis, klinikai tünetek és differenciáldiagnózis. Bőrgyógy Vener Szle 2017;93:218–224
5. Oranje AP, Glazenburg EJ, Wolkerstorfer A, et al. Practical issues on interpretation of scoring atopic dermatitis: the SCORAD index, objective SCORAD and the three-item severity score. Br J Dermatol 2007;57:645–648
6. Hanifin JM, Rajka G. Diagnostic features of atopic dermatitis. Acta Derm Venereol 1980;92:44–47
7. Williams HC, Burney PG, Hay RJ, et al. The UK workin party’s diagnostic criteria for atopic dermatitis. I. Derivation of a minimum set of discrimnators for atopic dermatitis. Br J Dermatol 1994;131:383–396
8. Gáspár K, Szegedi A. Az atópiás dermatitis diagnosztikája, differenciáldiagnosztikája. Bőrgyógy Vener Szle 2017;93:225–230
9. Barrett M, Luu M. Differential diagnosis of atopic dermatitis. Immunol Allergy Clin N Am 2017;37:11–34
10. Kinyó Á. Lokális terápia atópiás dermatitisben. Bőrgyógy Vener Szle 2017;93:231–233
11. Varga E, Kemény L. A kalcineurin gátlók alkalmazása atópiás dermatitisben. Bőrgyógy Vener Szle 2017;93: 235–239
12. Bata-Csörgő Zs. Az atópiás dermatitis szisztémás kezelése. Bőrgyógy Vener Szle 2017;93:240–242
a szerző cikkei
Ványai Beatrix
a szerző cikkei
Katona Melinda
a szerző cikkei
Dr. Szegedi Andrea
a szerző cikkei