A humán papillómavírus (HPV) magas rizikójú altípusai és a méhnyakrák kockázata
A közlemény célja, hogy rámutasson a magas rizikójú HPV-típusok egymástól különböző rákkeltő hatására. A leggyakoribb és legagresszívebb 16-os és 18-as fajta mellett felhívjuk a figyelmet a többi hr (high-risk) típus veszélyére és jelentőségére, továbbá hangsúlyozni kívánjuk a közismerten fontos méhnyakrák-megelőzési stratégiák (pl. a védőoltás) széles körű alkalmazásának fontosságát.
BEVEZETÉS

A méhnyakrák globálisan az egyik leggyakrabban diagnosztizált nőgyógyászati daganattípus, amely évente több mint félmillió nőt érint, és mintegy 300000 halálesetért felelős, különösen az alacsony és közepes jövedelmű országokban, ahol a szűrés és a megelőzés lehetőségei korlátozottak.1 A betegség hátterében egyértelműen azonosított vírusos etiológia áll: a humán papillómavírus (HPV) tartós fertőzése a méhnyak hámsejtjeiben elindítja azt a molekuláris és sejtszintű kóros folyamatot, amely hosszú évek alatt cervicalis intraepiteliális neopláziához (CIN), majd invazív karcinómához vezethet.2
A HPV rendkívül elterjedt, kettős szálú DNS-vírus, amely több mint 200 genotípussal rendelkezik, ezek közül azonban csak körülbelül 40 fertőzi meg az anogenitális régió hámját, és ezek közül is csupán 14 típus sorolható a magas rizikójú (high-risk, hr) kategóriába a daganatkeltő (onkogén) potenciáljuk alapján.3 A Nemzetközi Rákkutatási Ügynökség (IARC) klasszifikációja szerint a 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59, 66 és 68-as típusok tartoznak ebbe a csoportba, mivel ezek jelenléte szignifikánsan gyakoribb a méhnyakrákos esetekben, mint az egészséges populációban.4
A HPV-fertőzés önmagában azonban nem elégséges feltétele a daganat kialakulásának, hiszen a legtöbb fertőzés – különösen a fiatal nők körében – néhány hónapon, max. egy-két éven belül spontán módon eliminálódik a szervezet immunválasza révén. Ezzel szemben a tartósan fennálló fertőzések, különösen a 16-os és 18-as típus esetén, jelentős rizikót hordoznak a súlyos cervicalis elváltozások kialakulására. Csak ez a két típus felelős a méhnyakrákos esetek mintegy 70%-áért.5
MÓDSZER
A dolgozat célja a magas rizikójú humán papillómavírus (hrHPV) törzsek eltérő onkogén potenciáljának áttekintése volt, különös tekintettel a méhnyakrák kialakulásával való kapcsolatukra. Az irodalmi áttekintés során szisztematikus keresést végeztünk az angol nyelvű tudományos szakirodalomban, a PubMed, Scopus és Web of Science adatbázisokat felhasználva, időbeli korlátozás nélkül, de kiemelten kezelve a 2010 után publikált tanulmányokat, figyelembe véve a legfrissebb metaanalíziseket, multicentrikus kohorszvizsgálatokat és molekuláris epidemiológiai kutatásokat.
A keresési stratégiát előzetesen meghatározott kulcsszavak és Boole-algoritmus kombinációja alapján állítottuk össze, például: „HPV type-specific oncogenic risk”, „high-risk human papillomavirus”, „HPV 16 18 31 33 52 58 cervical cancer”, „HPV genotype distribution in CIN and carcinoma”. A találatokat PRISMA (Preferred Reporting Items for Systematic Reviews and Meta-Analyses) irányelvek alapján szelektáltuk, és a releváns cikkek bibliográfiáját is kiegészítettük kézi kereséssel.6
EREDMÉNYEK
A magas rizikójú humán papillómavírusok onkogén potenciálja jelentősen eltérő, és ezt a különbséget mind epidemiológiai adatok, mind molekuláris mechanizmusok igazolják. Az alábbiakban típusonkénti bontásban mutatjuk be a legfontosabb magas rizikójú törzseket, azok előfordulását, szövettani kapcsolatát és daganatkeltő potenciálját.
A HPV-16 messze a leggyakoribb és legagresszívebb onkogén HPV-típus, amely a világ méhnyakrákos eseteinek körülbelül 55–60%-ában azonosítható, és különösen magas arányban fordul elő laphámrákos szövettani típusokban.1 A típus hosszú távú perzisztenciája, valamint az általa kódolt E6 és E7 onkoproteinek a rendkívül hatékony p53 és Rb tumorszuppresszor fehérjék inaktiválását eredményezik, amely a daganatos transzformáció fő mozgatórugója.7
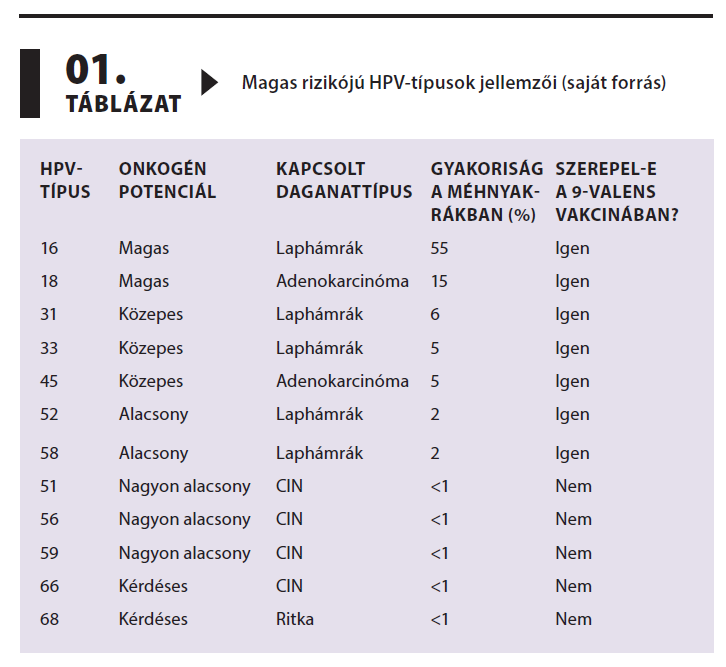
A HPV-18 az esetek további 10–15%-áért felelős, különösen az adenokarcinómák között, ahol előfordulása a 30–40%-ot is elérheti.3 E típus sajátossága, hogy gyakran rejtett, endocervicalisan lokalizált léziókat okoz, amelyek nehezebben detektálhatók citológiai szűréssel, így gyakrabban diagnosztizálják előrehaladottabb stádiumban.8
A HPV-31 és -33 onkogén potenciálja szintén magas, és epidemiológiai vizsgálatok alapján együtt a méhnyakrákos esetek 6–8%-áért lehetnek felelősek.5 A CIN3- elváltozások gyakorisága e típusok esetében is magas, és molekuláris profiljuk közelebb áll a HPV-16-hoz, mint a kevésbé onkogén típusokhoz.9
A HPV-45 a harmadik leggyakoribb típus az adenokarcinómákban, és előfordulása globálisan 3–5% közé tehető az invazív méhnyakrákos esetekben.10 Szoros filogenetikai rokonságban áll a HPV-18-cal, hasonló onkoprotein aktivitást mutatva, így különösen figyelemre méltó az adenokarcinóma megelőzése szempontjából.9
A HPV-52 és -58 típusok gyakorisága különösen Kelet-Ázsiában jelentős, ahol ezek a törzsek a méhnyakrákos esetek 10–15%-át is kiteszik, míg Európában ritkábban fordulnak elő.11 Onkogén potenciáljuk közepesnek tekinthető: bár perzisztens fertőzés esetén CIN2/3 kialakulása lehetséges, a progresszió sebessége és invazív karcinómába áttérésének aránya alacsonyabb, mint a HPV-16 vagy -18 esetében.12
A HPV-51, -56, -59, -66 és -68 típusokat a WHO szintén magas rizikójúnak sorolja be, azonban a legtöbb tanulmány alapján a relatív kockázatuk alacsonyabb.13 A HPV-51 és -56 például, bár gyakran jelen van CIN2-ben, ritkán mutatható ki invazív daganatokban.14 A HPV-66 és -68 szórványosan fordul elő, és egyes vizsgálatok kérdésessé teszik onkogén klasszifikációja fenntartását, mivel alig van adat CIN3-ban vagy invazív rákban való előfordulásáról.15
Az egyes HPV-típusokra vonatkozó jellemzőket összefoglalva az 1. táblázat szemlélteti.
KOINFEKCIÓK SZEREPE
Több tanulmány is beszámol arról, hogy a magas rizikójú HPV-típusok koinfekcióban gyakrabban detektálhatók, különösen a 52- es és 58-as típus fordul elő a HPV-16 mellett. E koinfekciók ugyanakkor nem mindig jelentenek additív onkogén hatást, sőt bizonyos esetekben kompetitív virológiai hatás is megfigyelhető, amely a vírusreplikáció vagy az onkogénexpresszió gátlását ered- ményezi.15
Összességében a HPV-16 és -18 kiemelt onkogenetikai szerepe megkérdőjelezhetetlen, míg a többi magas rizikójú típus differenciált kockázatot jelent, amit a szűrési és vakcinációs stratégiák kialakításánál figyelembe kell venni.
KÖVETKEZTETÉS
A humán papillómavírus (HPV) magas rizikójú típusainak eltérő onkogénpotenciálja mára számos molekuláris, epidemiológiai és klinikai vizsgálat eredményeként bizonyítást nyert. Bár az összes magas rizikójú típus potenciálisan képes méhnyakrák kialakítására, a különbségek a daganatképződés valószínűségében, típusonkénti előfordulásban és szövettani preferenciákban komoly gyakorlati jelentőségűek az egyéni kockázatbecslés, a szűrési algoritmusok és a megelőzési stratégiák meghatározásakor.1
A HPV-16 és -18 dominanciája a méhnyakrákos esetekben megingathatatlan: együttesen a daganatok több mint 70%- áért felelősek, a vakcinák első generációja e két típus ellen nyújtott védelmet.2,17
Ugyanakkor a 31, 33, 45, valamint földrajzilag kiemelt területeken az 52 és 58 típusok is jelentős mértékben hozzájárulhatnak a súlyos cervicalis diszpláziák és invazív daganatok kialakulásához. E törzsek közepes onkogén kockázata, valamint regionális prevalenciája miatt a kilenctípusú (9-valens) HPV-vakcinák bevezetése komoly előrelépés a globális prevencióban.4
Ezen megkülönböztetések különösen fontosak a HPV-alapú szűrés bevezetésének időszakában, hiszen egy pozitív eredmény nem jelent automatikusan azonos kockázatot minden esetben. A típusonkénti differenciálás, az egyéni rizikóbecslés és a célzott utánkövetés révén csökkenthető a túlkezelés aránya, miközben a magas rizikójú fertőzések korai detektálásával érdemben javítható a megelőzés hatékonysága.16
Végezetül, a HPV-típusok onkogén különbségeinek figyelembevétele nem csupán a klinikai döntéshozatalban, hanem az oltási stratégiák tervezésében is alapvető jelentőségű. A széles spektrumú vakcinák alkalmazása, különösen a 9-valens készítmények lehetővé teszik, hogy a globális HPV-terhelés jelentős része megelőzhetővé váljon, így érdemi lépéseket tehetünk a méhnyakrák eliminációja felé, ahogy azt a WHO 2030-as célkitűzései is megfogalmazzák. Különösen igaz ez, ha forgalomba kerül a komoly kutatás/fejlesztés nyomán jó eredménnyel kecsegtető terápiás HPV-ellenes vakcina. Ugyanakkor a globális lefedettség és az oltással kapcsolatos oktatási programok továbbra is fejlesztendők a célok elérése érdekében.10,17
Nyilatkozat. A közlemény más folyóiratban korábban nem jelent meg, és nincs elbírálás alatt. A szerzők elolvasták a szerzői útmutatót. A szerzők a cikk megírása, illetve a kutatómunka során anyagi támogatásban nem részesültek. Szerzői munkamegosztás: Dr. H. B: irodalomkutatás, szerkesztés, kézirat megszövegezése, Dr. M. Zs: kézirat megszövegezése, ellenőrzése, végső formába öntése. A cikk végleges változatát valamennyi szerző elolvasta és jóváhagyta. A szerzők egyikének sincs semmilyen érdekeltsége a közlemény megjelentetésével kapcsolatban. A dolgozat nem sérti a Helsinki deklaráció előírásait.
Levelezési cím:
This e-mail address is being protected from spambots. You need JavaScript enabled to view it.
Irodalom:
1. Arbyn M, Weiderpass E, Bruni L, et al. Estimates of incidence and mortality of cervical cancer in 2018: a worldwide analysis. Lancet Glob Health 2020;8:191–203
2. Garland SM, Hernandez-Avila M, Wheeler CM, et al. Quadrivalent vaccine against HPV to prevent anogenital diseases. N Engl J Med 2007;356:1928–1943
3. Tsakogiannis D, Zografos E, Tzioga L, et al. Prevalence and genotype distribution of high-risk HPV genotypes among women in Greece: A retrospective analysis of 3500 women. Cancers 2025;17:1267
4. Joura EA, Giuliano AR, Iversen OE, et al. A 9-valent HPV vaccine against infection and intraepithelial neoplasia in women. N Engl J Med 2015;372:711–723
5. Bosch FX, Lorincz A, Munoz N, et al. The causal relation between human papillomavirus and cervical cancer. J Clin Pathol 2002;55:244–265
6. Page MJ, McKenzie JE, Bossuyt PM, et al. The PRISMA 2020 statement: an updated guideline for reporting systematic reviews. BMJ 2021;372:n71
7. McLaughlin-Drubin ME, Münger K. Oncogenic activities of human papillomaviruses. Virus Res 2009;143:195–208
8. Kusakabe M, Taguchi A, Sone K, et al. Carcinogenesis and management of human papillomavirus associated cervical cancer. Int J Clin Oncol, 2023;28:965–974
9. Wheeler CM, Castellsagué X, Garland SM, et al. Cross-protective efficacy of HPV-16/18 AS04-adjuvanted vaccine against cervical infection and precancer caused by non-vaccine oncogenic HPV types Lancet Oncol 2012;10:221–229
10. WHO 2020. Global strategy to accelerate the elimination of cervical cancer as a public health problem. Geneva: WHO Press, 2020
11. de Sanjosé S, Quint WG, Alemany L et al. Human papillomavirus genotype attribution in invasive cervical cancer: a retrospective cross-sectional worldwide study. Lancet Oncol 2010;11:1048–1056
12. Munoz N, Bosch FX, de Sanjosé S, et al. Epidemiologic classification of human papillomavirus types associated with cervical cancer. N Engl J Med 2003;348:518–527
13. Bonde JH, Sandri MT, Gary DS, et al. Clinical utility of human papillomavirus genotyping in cervical cancer screening: A systematic review. J Low Genit Tract Dis 2020;24:1–13
14. Trottier H, Franco EL. The epidemiology of genital human papillomavirus infection Vaccine 2006;24(1):S1–S15
15. Chaturvedi AK, Katki HA, Hildesheim A, et al. Human papillomavirus infection with multiple types: pattern of coinfection and risk of cervical disease. J Infect Dis 2011;203:910–920
16. Wentzensen N, Schiffman M, Palmer T, et al. Triage of HPV positive women in cervical cancer screening. J Clin Virol 2016;76(1):S49-55
17. Szülészeti és Nőgyógyászati Infektológia, Ed. László Á, Sziller I. Oriold és Társai Kiadó, Budapest, 2019
a szerző cikkei
Dr. Melczer Zsolt PhD, MSc, Egyetemi docens, részlegvezető igazgatóhelyettes, Semmelweis Egyetem, Szülészeti és Nőgyógyászati Klinika
a szerző cikkei









