Előrehaladott multiplex arci spinalióma sikeres kezelése
A laphámkarcinóma, másik nevén spinocelluláris karcinóma vagy spinalióma a második leggyakoribb nem melanóma típusú bőrrák, és a második leggyakrabban halált okozó bőrdaganat. Esetbemutatásunk egy arci lokalizációjú, előrehaladott, irreszekábilis tumoros beteg sikeres cemiplimabkezelését ismerteti.
BEVEZETÉS
A nem melanóma bőrtumorok világszerte a leggyakoribb rosszindulatú daganatok közé tartoznak, és főként a 70 év feletti korosztályt érintik. A laphámkarcinóma a bazalióma után a második leggyakoribb előfordulású, a melanoma malignum után pedig a második leggyakoribb halált okozó daganat. Leggyakrabban a fej-nyaki régióban jelentkezik, kialakulásában leginkább a napsugárzás, különösen a krónikus UV-sugárzás játszik szerepet, de az immunszupprimált állapot és genetikai hajlam (világos bőrszín) is fokozza kialakulásának rizikóját. Nagy része műtéttel könnyen gyógyítható, ha korán felismerik. Lokálisan előrehaladott daganatnak olyan megbetegedést nevezünk, ahol nincs kimutatható távoli áttét, azonban a lokalizáció és a kiterjedés miatt a sebészi és/vagy sugárkezelés nagy deformitások árán bizonyulhat csak kuratívnak. A bőrről kiinduló laphámrákos daganatok 5%-a eredményez metasztázist, nagyobb részt regionális nyirokcsomókban, azonban távoli áttétek is előfordulhatnak.1,2 Áttétes, illetve lokálisan előrehaladott formájának kezelésében a platinaalapú kemoterápia, illetve EGFR-gátló kezelés nagyon alacsony tumorválaszt eredményez. Szisztémás terápiaként elérhetővé vált a PD-1-gátló, cemiplimab-immunterápia, melyet 2018 szeptemberében az FDA, 2019 júniusában az EMA törzskönyvezett lokálisan előrehaladott, sugár- és sebészeti kezelésre nem alkalmas, metasztatikus eredetű laphámkarcinómák kezelésére, amely mára a nemzetközi irányelvek szerint első vonalbeli kezelésnek minősül. Áttekintő vizsgálatok alapján egyéb szisztémás kezeléssel összehasonlítva (pl. pemprolizumab,) magasabb progressziómentes túlélést (PFS) és teljes túlélést (OS) eredményez, valamint a terápia mellékhatásprofilja is kedvezőbb. A cemiplimabkezelés alatt a betegséghez kapcsolódó fájdalom jelentős csökkenése, az életminőség javulása tapasztalható.3-6
ESETISMERTETÉS
A 86 éves férfi beteg anamnézisében hipertónia, illetve prosztatahiperplázia szerepel, amely miatt gyógyszeres kezelésben részesül.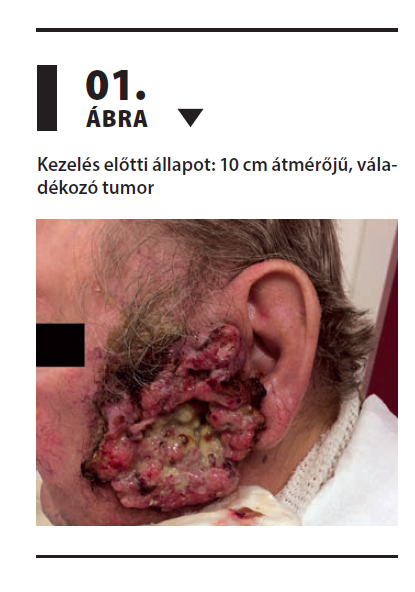
2022 októberében a fejtetőn lévő, 4 cm-es, bőr szintjéből előemelkedő tumor műtéti eltávolítása megtörtént 1 cm-es biztonsági zónával, a keletkezett hiányt a jobb combról vett félvastag bőrtranszplantátummal fedték. A szövettani vizsgálat közepesen differenciált laphámkarcinómát véleményezett, épben eltávolítva.
2023 júniusában fül-orr-gégészeten a bal oldalon a parotisznak megfelelően 3×3 cm-es térfoglalás igazolódott ultrahangvizsgálattal. A készült core biopszia planocelluláris karcinóma metasztázisát igazolta. A nyaki lágyrész és a mellkas CT-vizsgálatán a bal oldalon a parotiszállományt elfoglaló, kb. 42×32 mm-es, részben nekrotikus centrumú, inkább perifériás halmozást mutató, ismert térfoglalás látszott, a környezetében néhány apró, 10×6 mm-es nyirokcsomóval. Távoli áttét nem igazolódott. 2023 júliusában onkológiai szakbizottsági döntés alapján PET-CT és koponya-MR történt, ahol továbbra is észlelhető volt a bal oldalon a parotisz régiójában nagyméretű lágyrésztérfoglalás, távoli áttét nélkül. Eredmények birtokában az onkológiai szakbizottság palliatív sugárkezelést javasolt, melyet 5×5 Gy összdózisban, VMAT-tervezéssel 2023. augusztus 21–25. között kapott meg a beteg.
2023 novemberében a mellkas-CT negatív, nyaki lágyrész CT-vizsgálatán a bal oldalon preauricularisan elhelyezkedő, kb. 35×32×42 mm nagyságú, kontrasztanyagot halmozó térfoglaló képlet igazolódott, mely a parotisztól nem különíthető el. A nyakon egyéb kóros denzitáseltérés, megnagyobbodott lgl. nem volt detektálható.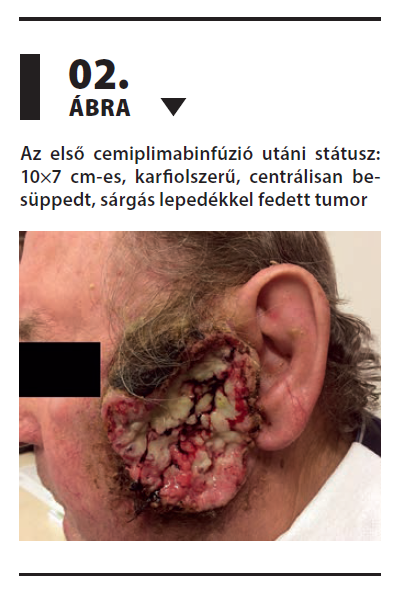
2024 februárjában a nyaki lágyrész CT-vizsgálatán progresszió volt észlelhető. A korábban a bal oldalon a parotisz régiójában leírt terime kb. 50×20 mm nagyságúra nőtt, centrumában nekrotikus területekkel. Az elváltozást ekkor már a musculus massetertől elkülöníteni nem lehetett, valamint a bal oldalon a nyaki nagyerek mellett az átlagosnál nagyobb számban, 10–14 mm-es méretű nyirokcsomók jelentkeztek. A nagyfokú progresszióra tekintettel az onkológiai szakbizottság a beteget onkodermatológiai ambulanciánkra irányította a további teendők elbírálása céljából.
2024 februárjában ambulanciánkon a fizikális vizsgálat során a bal fül előtt 10×10 cm-es, karfiolszerűen előemelkedő, centrálisan besüppedt, sárgás lepedékkel fedett, váladékozó tumor, míg a fejtetőn 2 cm-es, sárgásan lepedékes, centrálisan besüppedt tumor, valamint az orrháton 2 cm-es, előemelkedő terime helyezkedett el (1. ábra). Tekintettel a kielégítő általános állapotra (ECOG: 1) és a tumor lokalizációjára, nagyságára, a sebészeti ellátás és az ismételt sugárkezelés nem jött szóba, így a betegnél az onkoteam döntése értelmében, EMK beadása után cemiplimabkezelés indult. Az első infúziót 2024. március 11-én az előírtaknak megfelelően, panaszmentesen megkapta, 350 mg dózisban, 30 perces infúzió formájában. Második kezelésre április 2-án került sor, ennek során már észlelhető volt a tumor enyhe regresszója (2. ábra).
A 4 cemiplimabinfúzió adását követően készült képalkotó vizsgálatok a bal oldali parotiszrégióban elhelyezkedő térfoglalás jelentős mértékű regresszióját írták le regionális, illetve távoli áttét nélkül, melyet a klinikai kép is alátámasztott (3. ábra).
A 2. ciklusbeli kezelésre érkezve a beteg fáradékonyságról panaszkodott, hozott laborban hipotireózis volt észlelhető (TSH: 53,47 mU/l, fT4: <3,2 pmol/L), ezért endokrinológiai konzíliumot követően elkezdtük a szubsztitúciós kezelést.
A beteg rendszeresen, 3 hetente cemiplimabkezelésben részesült. A kezelés alatt 3 havonta CT-vizsgálat, valamint rendszeres fotódokumentáció készült. Az alkalmazott terápia mellett nemcsak a bal parotiszrégióban lévő tumor, hanem az orrháton és a fejtetőn lévő tumorok is regressziónak indultak, pszeudoprogressziót nem észleltünk.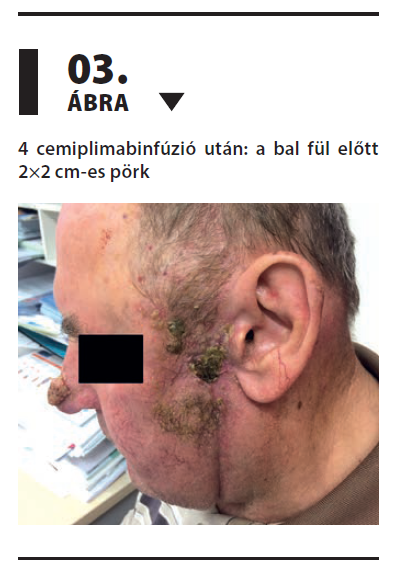
A 2025. február 4-én készült képalkotó vizsgálat is igazolta a klinikailag észlelt regressziót, azonban a bal parotiszban követett, az m. massetertől el nem választható, 14×37 mm átmérőjű és 52 mm hosszúságú halmozó, csontdestrukciót nem okozó, bőrfelszíntől el nem választható tumor továbbra is perzisztált. A folyamat tisztázása céljából a bal parotiszrégióból finomtű-aspirációs biopszia történt. A citológiai leletben elvétve egy-egy epithelsejt volt látható, malignitás jelei nélkül.
A mai napig a beteg összesen 16 infúziós cemiplimabkezelésben részesült. A bal parotiszban, illetve a fejtetőn észlelt ulcerációk hámosodtak, az orrháton lévő tumor mérete tovább csökkent, a beteg elmondása alapján életminősége nagymértékben javult (4. ábra). A páciens jelenleg is gondozásunk alatt áll, a 2025. július 21- én készült PET-CT-n egyértelmű FDG-avid makroszkópos malignus folyamat nem volt azonosítható a fejtetőn és a bal parotisz régiójában sem.
MEGBESZÉLÉS
A lokálisan előrehaladott, illetve metasztatizáló laphámkarcinómák ellátása napjainkban is kihívást jelent. Fontos a magas rizikójú esetek szoros nyomon követése, szükség szerinti reoperációja, az adjuváns sugárkezelés mérlegelése. Az elégtelen kemoterápiás próbálkozások helyett nagy előrelépést jelentett az anti-PD-1-kezelés bevezetése, mely a klinikai vizsgálatokban 50%-os, míg a real-life vizsgálatokban enyhén alacsonyabb objektív válaszarányt mutat. Mellékhatásai megegyeznek a többi anti-PD-1-kezelés során észleltekkel. A mi esetünkben jelentkező pajzsmirigy-funkciózavar gyakorinak mondható endokrin tünet, melynek gyakorisága rendkívül széles skálán mozog, akár 21–80% közé is tehető, azonban életveszélyes funkciózavar szerencsére ritkán jelentkezik. Grade 3 hipo- és hipertireózis előfordulása csupán az esetek 0,2%-ában észlelhető. A mellékhatások felismerését és kezelését azonban nehezíti az ebben a betegpopulációban jelentkező sok társbetegség és az ezekre szedett gyógyszerek hatása.7,8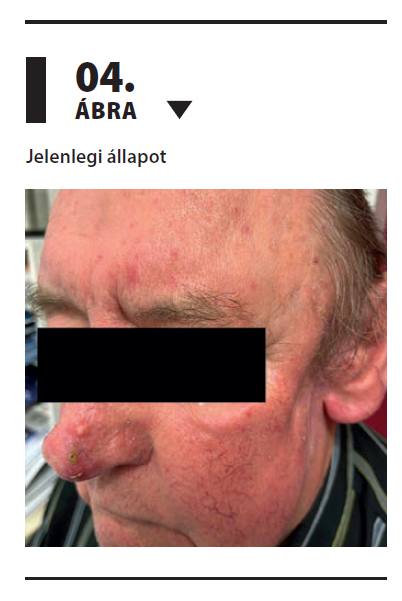
A kezelés hatékonyságának előrejelzésére nem rendelkezünk egyértelmű adatokkal, de intenzív kutatások folynak ennek felderítésére. Számos tényező lehet hatással a kezelés eredményességére, mint a tumor lokalizációja, mikrokörnyezete – ezen belül a tumort infiltráló limfociták prediktív szerepe –, társbetegségek – főként az immunszupprimált állapotok –, melyek nem kontraindikálják a kezelés megkezdését.9,10 Az életkor önmagában nem kontraindikációja az immunterápia bevezetésének, azonban a kezelés megkezdése előtt, személyre szabottan kell dönteni, értékelni kell a társbetegségeket, kognitív funkciókat.11
Esetünk szemlélteti, hogy irrezekábilis cutan spinocelluláris karcinóma sikeresen kezelhető PD-1-gátló immunellenőrzőpont-gátlókkal, valamint a kezelés jól tolerálható az idős betegcsoportban. Ugyanakkor szeretnénk felhívni a figyelmet annak fontosságára, hogy a nagy rizikójú, előrehaladott cutan laphámkarcinómás esetek haladéktalanul dermatoonkológiai centrumba irányítandók.
Nyilatkozat. A közlemény más folyóiratban korábban nem jelent meg, és nincs elbírálás alatt. A szerzők a cikk megírása, illetve a kutatómunka során anyagi támogatásban nem részesültek. A szerzőknek a cikk témájával kapcsolatos érdekeltsége nincs. A dolgozat nem sérti a Helsinki Deklaráció előírásait.
Levelezési cím:
This e-mail address is being protected from spambots. You need JavaScript enabled to view it.
Irodalom:
1. García-Foncillas J, Tejera-Vaquerizo A, Sanmartín O, et al. Update on Management Recommendations for Advanced Cutaneous Squamous Cell Carcinoma. Cancers (Basel) 2022;14(3):629
2. Stratigos AJ, Garbe C, Dessinioti C, et al. European interdisciplinary guideline on invasive squamous cell carcinoma of the skin: Part 2. Treatment. Eur J Cancer 2020;128:83-102, doi:10.1016/j.ejca.2020.01.008
3. Gambichler T, Scheel CH, Reuther J, Susok L. Management of immune-related adverse events in anti- PD-1-treated patients with advanced cutaneous squamous cell carcinoma. J Eur Acad Dermatol Venereol 2022;36(1):23-28
4. Keeping S, Xu Y, Chen CI, et al. Comparative efficacy of cemiplimab versus other systemic treatments for advanced cutaneous squamous cell carcinoma. Future Oncol 2021;17(5):611-627
5. Michael Robert Migden et al. Health-related quality of life (HRQL) in patients with advanced cutaneous squamous cell carcinoma (CSCC) treated with cemiplimab: Post hoc exploratory analyses of a phase II clinical trial. JCO 2020;38:10033-10033
6. Stratigos AJ, Garbe C, Dessinioti C, et al. European interdisciplinary guideline on invasive squamous cell carcinoma of the skin: Part 1. epidemiology, diagnostics and prevention. Eur J Cancer 2020;128:60-82
7. Szekanecz É, Szekanecz Z. Az onkológiában alkalmazott immuncheckpointgátló terápiák autoimmun mellékhatásai: patogenezis, klinikum és terápia [Autoimmune side effects of immune-checkpoint inhibitor therapies in oncology: pathogenesis, clinic and treatment]. Orv Hetil 2019;160(23):887-895
8. Barroso-Sousa R, Barry WT, Garrido-Castro AC, et al. Incidence of Endocrine Dysfunction Following the Use of Different Immune Checkpoint Inhibitor Regimens: A Systematic Review and Meta-analysis. JAMA Oncol 2018;4(2):173-182
9. Strippoli S, Fanizzi A, Quaresmini D, et al. Cemiplimab in an Elderly Frail Population of Patients With Locally Advanced or Metastatic Cutaneous Squamous Cell Carcinoma: A Single-Center Real-Life Experience From Italy. Front Oncol 2021;11:686308
10. Collins L, Quinn A, Stasko T. Skin Cancer and Immunosuppression. Dermatol Clin 2019;37(1):83-94
11. Dubianski R, Wildes TM, Wildiers H. SIOG guidelines-essential for good clinical practice in geriatric oncology. J Geriatr Oncol 2019;10(2):196-198
a szerző cikkei
Dr. Barta Barbara, Bőrgyógyász szakorvos, klinikai onkológus szakorvosjelölt, Somogy Vármegyei Kaposi Mór Oktató Kórház
a szerző cikkei











