Mágnesesrezonancia-elasztográfia 2.0 a lágyszövetek rugalmasságának, viszkozitásának, nyomásviszonyainak meghatározására
Az MR-elasztográfia kiterjeszti a radiológiai rétegvizsgálatok lehetőségeit az olyan mechanikai jellemzők feltérképezésének irányába, mint a rugalmasság, a viszkozitás vagy a nyomás. Elősegítheti a májfibrózisok stádiumának vizsgálatát, a daganattipizálást, a neurodegeneratív folyamatok észlelését, illetve a noninvazív nyomásmérést a szív vagy a máj területén. Az MR-elasztográfia 2.0 az MR-berendezéssel fölszerelt klinikákon és rendelőkben könnyen bevezethető, nagy diagnosztikai potenciállal bíró, ártalmatlan képalkotó eljárás a szervek és lágyrészek állapotának megítélésére.
Alapfogalmak
Elaszticitás
A tapintásos vizsgálatok a kezdetektől fogva részei az orvosi diagnosztika eszköztárának. A szövetekben a mechanikai nyújtás belső feszültséget hoz létre, a szövet ellene feszül a tapintó ujjnak, ennek mértéke a rugalmassági modulussal jellemezhető. A deformációs elaszticitás – vagy nyírási rugalmassági modulus – az emberi test szöveteiben mintegy nyolc nagyságrendet felölelő skálán változik, így minden más fizikai jellemzőnél érzékenyebb mérést tesz lehetővé. Az elasztográfia a nyírási rugalmasság rendkívül tág határok közötti változékonyságát használja ki, miközben a radiológiai rétegvizsgálati diagnosztika alapjaira épít. (26)
Viszkozitás
A nyírási rugalmassági modulus mellett a lágyszövetek viszkozitása, valamint az erekben és szövetekben uralkodó belső nyomás is fontos mechanikai információ a diagnosztika számára. A viszkozitás bepillantást nyújt a szövetek mikrostruktúrájába. Leegyszerűsítve azt mondhatjuk, hogy erősebb hálózatos kapcsolódás mellett a szövet jobban elnyeli a nyíráshullámokat, ami azt jelenti, hogy a viszkózus biológiai szövetek időben eltolva reagálnak a mechanikai ingerekre, s eközben mechanikai energiát nyelnek el (1. ábra). Valamely anyag kombinált viszkoelasztikus tulajdonságait a komplex nyírási modulus (G*) szabja meg. A komplex modulus valós része a rugalmasság mértéke (tárolási modulus, G'), képzetes része a viszkozitási tulajdonságokkal függ össze (veszteségi együttható, G”). Nagyon rugalmas anyag esetében – ilyen pl. az agaróz gél – igen kicsi a veszteségi együttható. A biológiai anyagba való átmenet szimulálható néhány papírcsík gélbe merítésével, ami nagymértékben növeli a G” értékét, anélkül hogy megváltoztatná a gél rugalmas tulajdonságait. (9,24)
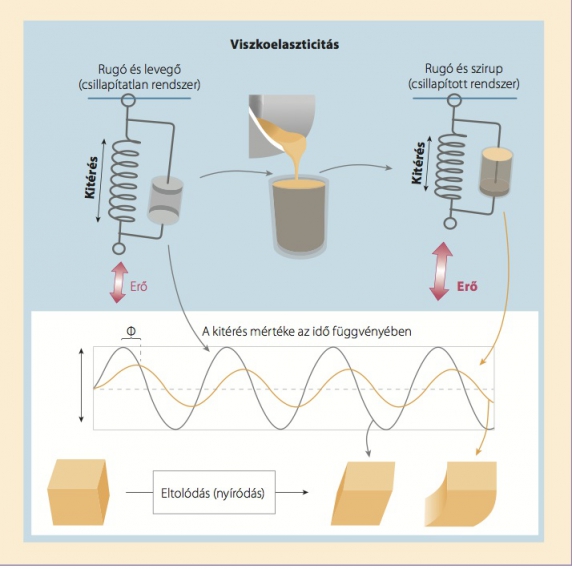
1. ábra. A „viszkoelaszticitás” a vizsgált anyag rugóval modellezhető elasztikus tulajdonságait és a rugó rezgéseit csillapító viszkozitási jellemzőit összegzi. Az ábrán a Voigtmodellt mutatjuk be a rugó és a csillapítás együttes hatásának példájaként. A rezgések „szirupszerű” közegben bekövetkező csillapodása (1) a rezgések kitérésének csökkenéséhez, (2) a válasz késlekedéséhez (Φ fázisszög) vezet, ami a kocka tolófeszültség miatti torzulásában (nyírás) is megnyilvánul (lent).
Nyomás
Bár a nyírófeszültség vagy a szöveti elmozdulás a biológiai szövetekben szigorúan térfogattartó deformációt hoz létre, mechanikai ingerek hatására minimálisan megváltozhat a szövetek térfogata a pórusok és mikrokapillárisok miatt. Ezeket az összenyomatási, illetve tágulási hatásokat, amelyek információt közvetítenek a szövetek belsejében uralkodó nyomásviszonyokról, poroelaszticitás néven foglaljuk össze. A szívelasztográfia alapját egy ettől teljes mértékben különböző nyomási törvényszerűség képezi. A szívelasztográfia esetében a létrehozott kamrai nyomás egyenes következménye a szívizomrostok összehúzódásának, és közvetlen kapcsolatban áll a miokardiális nyírási rugalmassági modulussal (2. ábra).
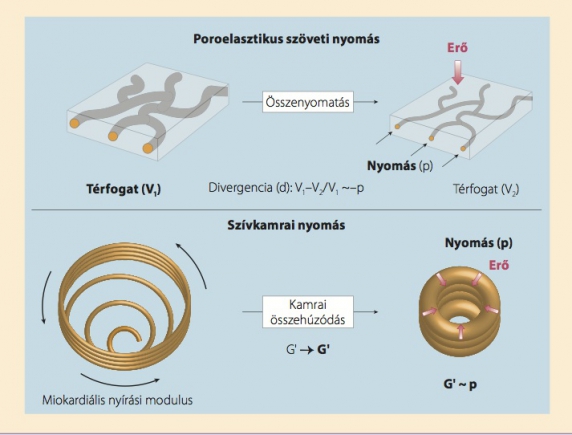
2. ábra. A „nyomás” elv az elasztográfiában vagy poroelasztikus tulajdonságokhoz, vagy a változó miokardiális nyírási modulushoz kapcsolódik. A poroelaszticitás előfeltétele, hogy legalább kétfázisú rendszerünk legyen, melynek egyik fázisa szilárd, a másik folyékony. A bemutatott példában az effektív médium összenyomhatósága az érrendszerbeli nyomásváltozásra vezethető vissza. A divergencia a térbeli torzulás mérőszáma, értéke arányos az érben uralkodó nyomással. A szívkamrai nyomás esetében a (csövekkel szimbolizált) szívizomrostok torziós összehúzódása – a G' nyírási együttható kifejezett növekedésével – közvetlenül egy sugárirányú erő létrejöttéhez és ezzel a kamrai nyomás emelkedéséhez vezet.
Az MR-elasztográfia technikai háttere
Az elasztográfia alapelve három módszertani lépést egyesít: (22) a szövetek mechanikai ingerlését; a létrehozott deformáció képének rögzítését ultrahanggal vagy MRI-technikával; és a képen látható kontraszt kiszámítását, ami információt ad a mechanikai mutatók eloszlásáról.
A mechanikai ingerlés lehet statikus, ezt külső nyomással hozzák létre, vagy dinamikus, amelyhez akusztikus vibráció által keltett mechanikai hullámokat használnak fel. A mechanikai hullámok, melyek fő komponensei transzverzális nyíráshullámok, fokuszált ultrahanggal (20) vagy tranziens, (2) illetve folyamatos vibrációval idézhetők elő. Folyamatosan gerjesztett transzverzális hullámok segítségével jobban vizsgálhatók a mélyebben fekvő szövetrétegek, míg a tranziens transzverzális hullámok viselkedése közelebb áll a síkhullámok terjedési modelljéhez.
Az emberi testben a 20–100 Hz-es frekvenciatartományban gerjesztenek transzverzális hullámokat. Az MR-elasztográfiában csak időben harmonikus rezgéseket használnak, mert a képalkotáshoz sokszor ismétlődő gerjesztésre és elnyelésre van szükség, melyek során önmagától beáll a mechanikai hullámok egyensúlyi állapota (steady state). Ezenkívül az időben harmonikus rezgések alkalmazása praktikusnak bizonyult a jól védett helyen lévő szervek – agy, szív – mechanikai ingerlése céljára.
A viszkoelasztikus tulajdonságoknak a hullámok formájából történő becsléséhez szükség van az elasztográfia ún. inverz problémájának megoldására. A hullámegyenletet numerikusan a komplex nyírási modulusra (G*) oldják meg. Az összetett viszkoelasztikus tulajdonságok pontos felderítéséhez széles frekvenciatartományban kell meghatározni a komplex együtthatót. (25) A többfrekvenciás MR-elasztográfiában eddig 25 és 65 Hz közti frekvenciákat alkalmaztak. (17) Az összenyomatás és a szöveti nyomás meghatározásához háromdimenziós hullámterek felvételére van szükség, ami jelenleg csak MR-elasztográfia útján lehetséges. (12,23)
Nagy felbontású MR-elasztográfia
Az MR-elasztográfia klinikai diagnosztikai felhasználása egyelőre a viszkoelasztikus szöveti tulajdonságok diffúz változásainak felderítésére korlátozódik. Példaként említhető a májfibrózis stádiumának vizsgálata (1,15,32) vagy a sclerosis multiplex neurodegeneratív folyamatainak feltárása. (29,31) Viszkoelasztikus térképek ábrázolására és regionális értelmezésére eddig csak korlátozottan volt lehetőség a hulláminverzióhoz tartozó pontatlan és kedvezőtlen határfeltételek miatt. Ezt a rezgő húr álló hullámhegyeivel és hullámvölgyeivel illusztrálhatjuk. A hullámcsomók területén nulla a kitérés, vagyis nem történik elasztikus deformáció, tehát ezekben a régiókban nem nyerhető elasztográfiás információ.
A probléma rossz matematikai megfogalmazását küszöböli ki a többfrekvenciás MR-elasztográfia. A rezgő húr példája alapján könnyen elképzelhető, hogy különböző rezgési frekvenciák esetén a csomópontok más-más helyen alakulnak ki, illetve a véletlenszerű sajátrezgéseket csak egyes frekvenciák találják el. A kritikus területeket közömbösítik a különféle más gerjesztési frekvenciák, így a matematikai probléma jobban megragadható. Ennek előfeltétele, hogy a többfrekvenciás hullámtérképek teljes információtartalmát egyetlen inverziós lépésbe foglaljuk össze egy túlhatározott egyenletrendszer megoldásaként.
Ezt az ún. többfrekvenciás inverziót csak 2012-ben vezették be a többfrekvenciás MR-elasztográfiába, (21) eddig a máj és az agy vizsgálatában mutatták be alkalmazását. (10) Technikai széljegyzetként megjegyzendő, hogy a komplex G* modulus, amely eredetileg valós és képzetes részből tevődött össze, a többfrekvenciás MR-elasztográfiában értékével (|G*|) és fázisszögével (Φ) jelenik meg. A G' és G” együtthatókhoz hasonlóan a |G*| és a Φ is tapintási tapasztalatainkat számszerűsítik: hogy egy anyag mennyire merev vagy puha (|G*|), illetve hogy egy szövet/anyag rostjai sűrű hálózatot (pl. májszövet) vagy lazább hálózatot (pl. agaróz gél) alkotnak (Φ). (10) A 3. ábra példákat mutat be a máj, illetve az agy többfrekvenciás MR-elasztográfiájára.
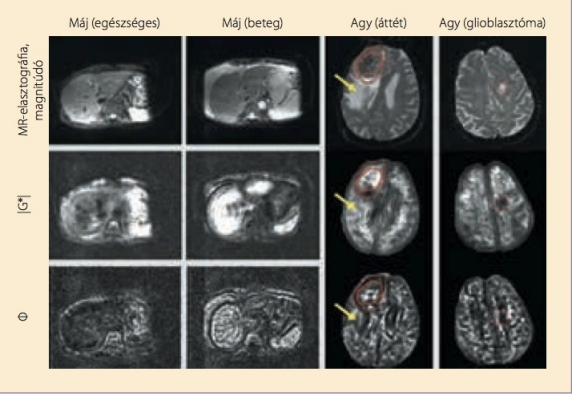
3. ábra. Háromdimenziós többfrekvenciás MR-elasztográfia a hasi szervekről és az agyról.10 A komplex nyírási modulus értéke (|G*|) fejezi ki a szövet merevségét, míg a fázisszög (Φ) a szövet viszkozitásából adódik (lásd az 1. ábrát). Az MR-elasztográfiás térkép szürkeskáláját 0 és 3 kPa (|G*|), illetve 1,5 rad (Φ) között osztják föl. Balra: harmadfokú fibrózis következtében a beteg mája lényegesen merevebb és viszkózusabb, mint az egészséges kontrollszemélyé. Az aszcitesz nem okozott technikai nehézséget az MR-elasztográfia során. A jól látható lép összességében a májnál merevebb, és magasabb Φ-értékeket mutat. Jobbra: agydaganatok mechanikai jellemzése. A tüdőkarcinóma áttéte merevebb a környező szöveteknél (piros vonal), és kifejezett perifokális ödéma övezi (nyíl), mely egy lágy, keskeny szegélytől (pontozott piros vonal) eltekintve nem okoz merevségváltozást, a Φ érték viszont jelentős mértékben módosul. A metasztázissal ellentétben a glioblasztóma (pontozott piros vonal) lágy, az agy szöveteivel megegyező szerkezetű daganat, mechanikai jellemzői viszkózus folyadékra emlékeztetnek.
A szív MR-elasztográfiája
A szív elasztográfiájával első ízben sikerült nem invazív módon megmérni a szívizom nyírási modulusának változását a szívciklus alatt. Minthogy a szívfal rugalmasságának változása a kamrai nyomásváltozás motorja, a nyíróerő változását leképező elasztográfia közvetlen, beavatkozásmentes lehetőséget kínál a kamrai nyomás mérésére és ezzel a szív nyomás térfogat munkájának meghatározására.
Eddig időben harmonikus, 25–30 Hz frekvenciájú hullámokat alkalmaztak a humán szívelasztográfiás vizsgálatokhoz. (28) A többi ingerlési eljárás – pl. fokuszált ultrahangimpulzusok, intrinszik aktiváció – biztonságossága és reprodukálhatósága még ellenőrzésre szorul. (14,16) A kisebb gerjesztési frekvenciákon, időben harmonikus hullámok segítségével végzett elasztográfia nagy kihívása a viszonylag nagy (10 cm körüli) hullámhossz és a szívizom meglehetősen nagy heterogenitása. Ez okból a szívelasztográfia során elemzik a nyíráshullámok amplitúdóját: a hullámok amplitúdójának növekedése és csökkenése tükrözi a nyírási modulus reciprok változásait a szív falának elernyedésekor (diasztolé) és összehúzódásakor (szisztolé). (28) Ilyenformán a szívelasztográfia képet ad a reciprok kamrai nyomásváltozásokról. Ezt az elvet állatkísérletekben validálták,5 és egészséges önkénteseken is vizsgálták, MR-elasztográfiával, (6) illetve időben harmonikus ultrahang-elasztográfiával. (30) Az első humán vizsgálatok igazolták a kardiális MR-elasztográfia diagnosztikai jelentőségét a szívizom relaxációs zavarainak felderítésében. (3,4)
Poroelasztográfia
Homogén anyagban a térfogat változása a hidrosztatikus nyomás növekedéséhez vezethet, ami a kompressziós együttható és a divergencia negatív szorzatának felel meg. A lágyszövetek kompressziós modulusa mintegy hat nagyságrenddel nagyobb a nyírási modulusnál, ami azt jelenti, hogy a lágyszövetek szinte összenyomhatatlanok. Ezért az ultrahanghullámok terjedési sebessége a szövetekben (kompressziós hullámok) közel azonos a vízben való terjedésük sebességével: mintegy 1500 m/s. Az elasztográfia, 100 Hz-nél kisebb gerjesztési frekvenciákkal, egészen más dinamikai területet fed le, ahol csak zárt térben lévő, folyadék ki- és beáramlása nélküli szövetekre alkalmazható megbízhatóan. A statikus nyomásnak, illetve kis (25 Hz körüli) frekvenciájú harmonikus vibrációnak kitett biológiai szövetekben kifejezett térfogatváltozás mérhető. (12,18) E megfigyelések alapján feltételezhető, hogy a biológiai szövetekben a kompressziós modulus valós értéke kis frekvenciájú ingerlés mellett jóval kisebb, mint azt korábban gondoltuk. Ez a jelenség a víztartalmú (összenyomhatatlan), mikropórusokkal átszőtt szövet modelljével magyarázható, melyben a mikropórusok alkotta csatornákban viszonylag szabadon áramló folyadék kitérhet a szövetre gyakorolt nyomás elől (2. ábra).
A vérrel telt hajszálerekkel átszőtt biológiai szövetek kielégítik a fenti feltételeket, amennyiben a mechanikai nyomás statikus, illetve a növekedése nem túl gyors. Ezzel szemben a megaherz tartományba eső centrális frekvenciájú ultrahanghullámok olyan gyors oszcillációt indukálnak, hogy a póruscsatornákban lévő folyadék nem képes kompenzálni a kompressziós hullámokat. E nagyfrekvenciás dinamikus stimuláció hatására a vizsgált szövet monofázisos, csaknem összenyomhatatlan anyagként viselkedik. A kis frekvencia alkalmazásakor tapasztalható összenyomhatóság az erekben uralkodó nyomás függvénye, (19,23) és lehetőséget ad arra, hogy a poroelasztográfia segítségével noninvazív módon meghatározzuk a nyomáseloszlást a lágyszövetekben. A poroelasztográfia feltétele a szövetek bármely irányú deformációjának észlelése. Deformációk három dimenzióban történő észlelése manapság kizárólag MR-elasztográfiával lehetséges. Az ultrahangelasztográfia – a laterális mozgás gyenge érzékelése miatt – jelenleg még nem alkalmas a térfogati hatások meghatározására. Poroelasztikus stimulusokként a kísérleti tanulmányokban az agyi artériás pulzációt használták, illetve kívülről indukált vibrációt alkalmaztak. (12,13) A nyomásfüggő térfogatváltozást a tüdőben, (13) az agyban (12) és a májban (11) vizsgálták (4. ábra).
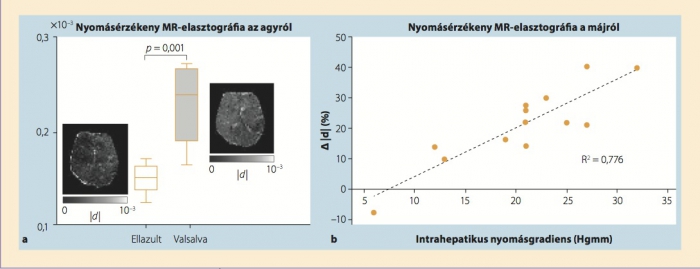
4. ábra. Nyomásérzékeny MR-elasztográfia a májról és az agyról. Nyomásérzékeny paraméterként a térbeli deformációt (divergencia, |d|, lásd 2. ábra) alkalmazták. A nyolc egészséges önkéntessel végzett egyszerű kísérlet (a) megmutatta, hogy Valsalva-manőver során, emelkedett koponyaűri nyomás következtében a kívülről keltett nyomáshullámok lényegesen nagyobb amplitúdójúak.12 Portális hipertenzióval élő betegek csoportjában (b) kimutatták, hogy a máj összenyomhatóságának söntbeültetés miatti változása korrelál a portális rendszer invazív úton mért nyomásgradienseivel.11
Egy előzetes vizsgálatban portális hipertenzióban szenvedő betegek májában sikerült nem invazív módon meghatározni a transzjuguláris intrahepatikus-portoszisztémás shunt (TIPS) behelyezése nyomán bekövetkezett nyomáscsökkenést. (11) A poroelasztográfia segítségével számszerűsített térfogatváltozás korrelált az invazív úton meghatározott intrahepatikus nyomásgradiensekkel (4. ábra). Összességében a poroelasztográfia nyomásfüggő paraméterekről szolgáltat adatokat, amelyek az MR-elasztográfia során nyert viszkoelasztikus nyírási modulu sokkal kiegészítik egymást, s egyazon háromdimenziós többfrekvenciás MR-elasztográfiás adatsorból határozhatók meg. MRI során mintegy 10 perces kiegészítő vizsgálattal megmérhető a három egymástól független mechanikai jellemző: a rugalmasság, a viszkozitás és a nyomás.
Klinikai alkalmazások: a máj és az agy MR-elasztográfiája
Az MR-elasztográfia kvantitatív, strukturszenzitív eljárás. Legszélesebb körben a májfibrózis stádiumának noninvazív besorolásában alkalmazzák, mert a májszövet szerkezete kollagénlerakódás és sövényképződés miatt megváltozik. (1,15,32) A máj MR-elasztográfiájának mai állásáról a szakirodalomban áttekintő közlemény olvasható. (27) Az időközben széles körben elterjedt ultrahangos májelasztográfiás eljárásokkal (7,8,33) szemben a máj MR-elasztográfiájának előnye a nagy pontosság és az, hogy lehetővé teszi a nagymértékben elhízott és a súlyos aszcitesszel élő betegek vizsgálatát. A diagnosztikai előnyök további kiteljesedése az MR-elasztográfia 2.0 verziójától (nagy felbontású többfrekvenciás 3D MR-elasztográfia) várható. (10)
Az MR-elasztográfia további, igen érdekes felhasználási területe a neurodegeneratív folyamatok korai felismerése. Akárcsak májfibrózisban, a neurodegeneratív betegségekben is megváltoznak a parenchima mechanikai tulajdonságai, pl. a sclerosis multiplex kísérő tüneteként. Ezek – a májfibrózistól eltérően – a rugalmasság csökkenésével járhatnak. (29,31) A betegvizsgálati adatok és egérkísérletek tanúsága alapján egyre több jel utal arra, hogy közvetlen összefüggés van a neuronális degeneráció és az agy rugalmassága között. Mindez arra ösztönöz, hogy klinikai-diagnosztikai tesztként használjuk az agy „tapintásos” vizsgálatát a neuronális szerkezetek mechanikai tartásának, integritásának megítélésére. A háromdimenziós, többfrekvenciás technika ez esetben is jelentősen növelné a vizsgálat szenzitivitását a lokális léziók, pl. a normális nyomással társuló hidrocefalusz kapcsán előálló periventrikuláris szöveti károsodás felderítésében. A nyomásmérésen alapuló MR-elasztográfia diagnosztikai értékét eddig nem kutatták.
Összegzés
Új technikai fejlesztések lehetővé teszik komplett háromdimenziós hullámterek felvételét több mechanikai gerjesztési frekvencián, az MRI-t kiegészítő tízperces vizsgálat keretében. Az elasztográfiával nyert információt eddig a viszkoelasztikus térképek felbontásának növelésére, illetve a szövetekben nyomás hatására végbemenő térbeli deformáció meghatározására használták. Az MR-elasztográfia az első képalkotó modalitás a radiológusok kezében, amelynek fizikai kontrasztmechanizmusa a lágyszövetek sejtjeinek mechanikai kapcsolódásán, illetve az érrendszer és a kötött szöveti struktúrák nyomásfüggő kölcsönhatásán alapul. A kardiális elasztográfia mint nyomásérzékeny képalkotó modalitás alkalmas a szívizomzat relaxációs zavarainak vizsgálatára. Jelenleg valós idejű felvétel készítésére szolgáló ultrahangos vizsgálómódszerként tesztelik. Az elasztográfia mint egyfajta „fizikai kontrasztanyaggal” végzett vizsgálat nagy orvosi-diagnosztikai jelentőségre tehet szert.
Nyilatkozat. A szerző nem jelzett érdekütközést.
Köszönetnyilvánítás. Köszönet illeti R. Ehmant az inspiráló beszélgetésekért, különösen az 1. ábrával kapcsolatban.
MAGNETRESONANZELASTOGRAPHIE 2.0: HOCHAUFGELÖSTE BILDGEBUNG ZUR BESTIMMUNG VON ELASTIZITÄT, VISKOSITÄT UND DRUCK WEICHER GEWEBE • VOL 138 / NO 47 / 2013 / DEUTSCHE MEDIZINISCHE WOCHENSCHRIFT
Levelezési cím: This e-mail address is being protected from spambots. You need JavaScript enabled to view it.
Irodalom:
1. Asbach P, Klatt D, Schlosser B, et al. Viscoelasticity-based staging of hepatic fibrosis with multifrequency MR elastography. Radiology 2010;257:80–86
2. Catheline S, Wu F, Fink M. A solution to diffraction biases in sonoelasticity: The acoustic impulse technique. Journal of the Acoustical Society of America 1999;105:2941–2950
3. Elgeti T, Beling M, Hamm B, et al. Cardiac magnetic resonance elastography: toward the diagnosis of abnormal myocardial relaxation. Invest Radiol 2010;45:782–787
4. Elgeti T, Beling M, Hamm B, et al. Elasticity-based determination of isovolumetric phases in the human heart. J Cardiovasc Magn Reson 2010;12:60
5. Elgeti T, Laule M, Kaufels N, et al. Cardiac MR elastography: comparison with left ventricular pressure measurement. J Cardiovasc Magn Reson 2009;11:44
6. Elgeti T, Rump J, Papazoglou S, et al. Cardiac magnetic resonance elastography – initial results. Invest Radiol 2008;43:762–772
7. Friedrich-Rust M, Ong MF, Herrmann E, et al. Real-time elastography for noninvasive assessment of liver fibrosis in chronic viral hepatitis. AJR Am J Roentgenol 2007;188:758–764
8. Ganne-Carrie N, Ziol M, de Ledinghen V, et al. Accuracy of liver stiffness measurement for the diagnosis of cirrhosis in patients with chronic liver diseases. Hepatology 2006;44:1511–1517
9. Guo J, Posnansky O, Hirsch S, et al. Fractal network dimension and viscoelastic powerlaw behavior: II. An experimental study of structure-mimicking phantoms by magnetic resonance elastography. Phys Med Biol 2012;57:4041–4053
10. Hirsch S, Guo J, Papazoglou S, et al. MR elastography of the liver and the spleen using a piezoelectric driver, single-shot wave-field acquisition, and multifrequency dual parameter reconstruction. Magn Reson Med 2013;DOI 10.1002/mrm.24674
11. Hirsch S, Guo J, Reiter R, et al. Towards compression-sensitive magnetic resonance elastography of the liver: Sensitivity of harmonic volumetric strain to portal hypertension. J Magn Reson Imaging 2013; DOI:10.1002/jmri.24165
12. Hirsch S, Klatt D, Freimann F, et al. In vivo measurement of volumetric strain in the human brain induced by arterial pulsation and harmonic waves. Magn Reson Med 2012; doi:10.1002/ mrm.24499
13. Hirsch S, Posnansky O, Papazoglou S, et al. Measurement of vibration-induced volumetric strain in the human lung. Magn Reson Med 2013;69:667–674
14. Hsu SJ, Bouchard RR, Dumont DM, et al. In vivo assessment of myocardial stiffness with acoustic radiation force impulse imaging. Ultrasound Med Biol 2007;33:1706–1719
15. Huwart L, Sempoux C, Salameh N, et al. Liver fibrosis: noninvasive assessment with MR elastography versus aspartate aminotransferase-to-platelet ratio index. Radiology 2007;245:458–466
16. Kanai H. Propagation of spontaneously actuated pulsive vibration in human heart wall and in vivo viscoelasticity estimation. IEEE Trans Ultrason Ferroelectr Freq Control 2005;52:1931– 1942
17. Klatt D, Hamhaber U, Asbach P, et al. Noninvasive assessment of the rheological behavior of human internal organs using multifrequency MR elastography: A study of brain and liver viscoelasticity. Phys Med Biol 2007;52:7281–7294
18. Konofagou EE, Harrigan TP, Ophir J, et al. Poroelastography: imaging the poroelastic properties of tissues. Ultrasound Med Biol 2001;27:1387–1397
19. Leiderman R, Barbone PE, Oberai AA, et al. Coupling between elastic strain and interstitial fluid flow: ramifications for poroelastic imaging. Phys Med Biol 2006;51:6291–6313
20. Nightingale K, Soo MS, Nightingale R, et al. Acoustic radiation force impulse imaging: in vivo demonstration of clinical feasibility. Ultrasound Med Biol 2002;28:227–235
21. Papazoglou S, Hirsch S, Braun J, et al. Multifrequency inversion in magnetic resonance elastography. Phys Med Biol 2012;57:2329–2346
22. Parker KJ, Huang SR, Musulin RA, et al. Tissue response to mechanical vibrations for „sonoelasticity imaging”. Ultrasound Med Biol 1990;16:241–246
23. Perrinez PR, Kennedy FE, Van Houten EEW, et al. Modeling of Soft Poroelastic Tissue in Time-Harmonic MR Elastography. IEEE Trans Biomed Eng 2009;56:598–608
24. Posnansky O, Guo J, Hirsch S, et al. Fractal network dimension and viscoelastic powerlaw behavior: I. A modeling approach based on a coarsegraining procedure combined with shear oscillatory rheometry. Phys Med Biol 2012;57:4023–404025. Riek K, Klatt D, Nuzha H, et al. Wide-range dynamic magnetic resonance elastography. J Biomech 2011;44:1380–1386
26. Sack I. Magnetresonanz-Elastographie. Dtsch Med Wochenschr 2008;133:247–251
27. Sack I, Fischer T, Thomas A, et al. Magnetresonanzelastographie der Leber. Der Radiologe 2012;52:738–744
28. Sack I, Rump J, Elgeti T, et al. MR elastography of the human heart: Noninvasive assessment of myocardial elasticity changes by shear wave amplitude variations. Magn Reson Med 2009;61:668–677
29. Streitberger KJ, Sack I, Krefting D, et al. Brain viscoelasticity alteration in chronic-progressive multiple sclerosis. PloS one 2012;7:e29888
30. Tzschatzsch H, Elgeti T, Rettig K, et al. In Vivo time harmonic elastography of the human heart. Ultrasound Med Biol 2012;38:214–222
31. Wuerfel J, Paul F, Beierbach B, et al. MR-elastography reveals degradation of tissue integrity in multiple sclerosis. Neuroimage 2010;49:2520– 2525
32. Yin M, Talwalkar JA, Glaser KJ, et al. Assessment of hepatic fibrosis with magnetic resonance elastography. Clin Gastroenterol Hepatol 2007;5:1207–1213 e1202
33. Ziol M, Handra-Luca A, Kettaneh A, et al. Noninvasive assessment of liver fibrosis by measurement of stiffness in patients with chronic hepatitis C. Hepatology 2005; 41: 48–54






