Colorectalis carcinoma és post-polypectomiás utánkövetés az amerikai és európai irányelvek tükrében
A colorectalis carcinoma az esetek döntő többségében endoszkópos vizsgálatok során felismerhető prekurzor elváltozások, adenomák malignus transzformációjával fejlődik ki. A folyamat időigényes volta, az érzékeny diagnosztikus és hatékony terápiás lehetőségek miatt optimális jelölt a szekunder prevencióra, ezért a gasztroenterológiai társaságok már évtizedek óta szorgalmazzák a populációs szintű szűrés bevezetését. Ennek kulcsfontosságú módszere a colonoscopia, mely a szűrővizsgálatok során átlagosan minden második, az alappopulációban minden negyedik betegnél detektál polypot. Jelen közlemény célja ezért áttekinteni és összevetni a vastagbélszűrésre, illetve post-polypectomiás utánkövetésre vonatkozó nemzetközi irányelveket.
BEVEZETÉS
 A colorectalis carcinoma (CRC) világszerte jelentős népegészségügyi problémát jelent magas incidenciája és mortalitása miatt. Ez teszi ki az összes újonnan igazolt daganatos megbetegedés mintegy 10%-át, ezzel a nők körében a második, míg férfiaknál a harmadik leggyakrabban diagnosztizált daganattípus.1 Kiemelendő továbbá, hogy Európában Magyarország vezető helyen áll a vastagbélrák incidenciája tekintetében. Kialakulásához az esetek döntő többségében polyp formájában megjelenő adenomák malignus transzformációja vezet. Ez a lassú, éveken át tartó folyamat lehetőséget biztosít a daganat megelőzésére a premalignus lézió eltávolításával, és másrészt a korai stádiumban felismert elváltozások alacsony mortalitással járnak. A nemzeti és nemzetközi gasztroenterológia társaságok ezért egyaránt szorgalmazzák a populációs szintű CRC-szűrőprogramok elindítását, amelynek a kivitelezésére vonatkozó irányelvek már rendelkezésre állnak az általános kockázatú és kiemelt kockázatú populációra vonatkozóan egyaránt. Emellett több országban, köztük hazánkban is kidolgozásra került a helyi infrastrukturális hátteret és humán erőforrásokat figyelembe vevő eljárásrend, protokoll.
A colorectalis carcinoma (CRC) világszerte jelentős népegészségügyi problémát jelent magas incidenciája és mortalitása miatt. Ez teszi ki az összes újonnan igazolt daganatos megbetegedés mintegy 10%-át, ezzel a nők körében a második, míg férfiaknál a harmadik leggyakrabban diagnosztizált daganattípus.1 Kiemelendő továbbá, hogy Európában Magyarország vezető helyen áll a vastagbélrák incidenciája tekintetében. Kialakulásához az esetek döntő többségében polyp formájában megjelenő adenomák malignus transzformációja vezet. Ez a lassú, éveken át tartó folyamat lehetőséget biztosít a daganat megelőzésére a premalignus lézió eltávolításával, és másrészt a korai stádiumban felismert elváltozások alacsony mortalitással járnak. A nemzeti és nemzetközi gasztroenterológia társaságok ezért egyaránt szorgalmazzák a populációs szintű CRC-szűrőprogramok elindítását, amelynek a kivitelezésére vonatkozó irányelvek már rendelkezésre állnak az általános kockázatú és kiemelt kockázatú populációra vonatkozóan egyaránt. Emellett több országban, köztük hazánkban is kidolgozásra került a helyi infrastrukturális hátteret és humán erőforrásokat figyelembe vevő eljárásrend, protokoll.

A colonoscopia kulcsfontosságú modalitás minden CRC-szűrőprogramban, mert nemcsak diagnosztikára, hanem egyúttal terápiára is lehetőséget biztosít: segítségével legtöbbször együlésben végezhető el a precancerosus léziók eltávolítása, a polypectomia, illetve a malignus elváltozás igazolásához szükséges biopsziás mintavétel. A nemzetközi adatok alapján a szűrt populációban a szűrő colonoscopiával és polypectomiával a CRC incidenciájának 25%-os, mortalitásának pedig 50%-os csökkenése érhető el a szűrésen át nem esett populációhoz viszonyítva.2,3 A kétlépcsős, immun székletvérteszten (FIT) és colonoscopián alapuló programokban 33,5–51,5% közötti adenomadetekciós rátáról számoltak be, melyet a polypok detekciós rátája 10-15%-kal halad meg. A polypectomiát követő ellenőrzésre vonatkozó ajánlások sokat változtak az utóbbi években, és bár alapelveikben megegyeznek, eltérés mutatkozik az európai és az amerikai irányelvek között.
A COLORECTALIS CARCINOMA SZŰRÉSÉRE VONATKOZÓ AJÁNLÁSOK
Több ajánlás áll rendelkezésre a CRC szűrésére vonatkozóan, közülük a 2020 után publikált irányelvek főbb javaslatait az 1. táblázat foglalja össze. Kiemelendő, hogy korábban egységesen a betöltött 50. életévet jelölték meg a szűrés kezdő időpontjának az általános rizikójú populáció esetében. Az új irányelvek azonban felhívják a figyelmet a CRC-incidenciában tapasztalt változásra, miszerint a 45–49 éves populációban az előrehaladott CRC előfordulása szinte megegyezik az 50–59 éveseknél tapasztalttal. A szűrés előnyeit, várható kockázatát és költségeit modellező tanulmányok szintén a szűrőpopuláció kiterjesztése mellett foglaltak állást. A 75 év feletti korosztály esetében döntően egyedi mérlegelést javasolnak az irányelvek, ennél a páciens általános állapotának, társbetegségeinek, várható élettartamának, szűrési előzményeinek és egyéni preferenciáinak figyelembevétele szükséges.
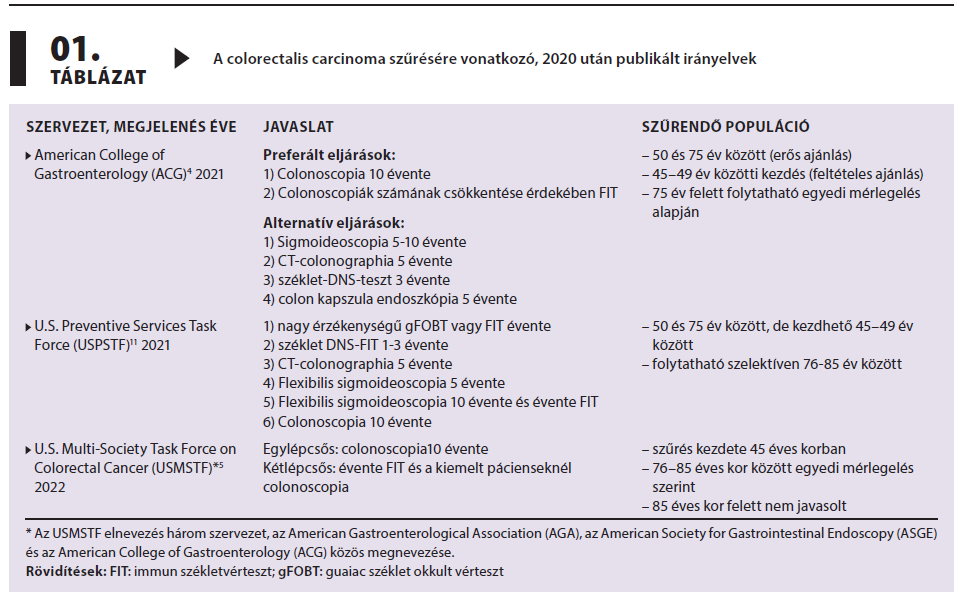
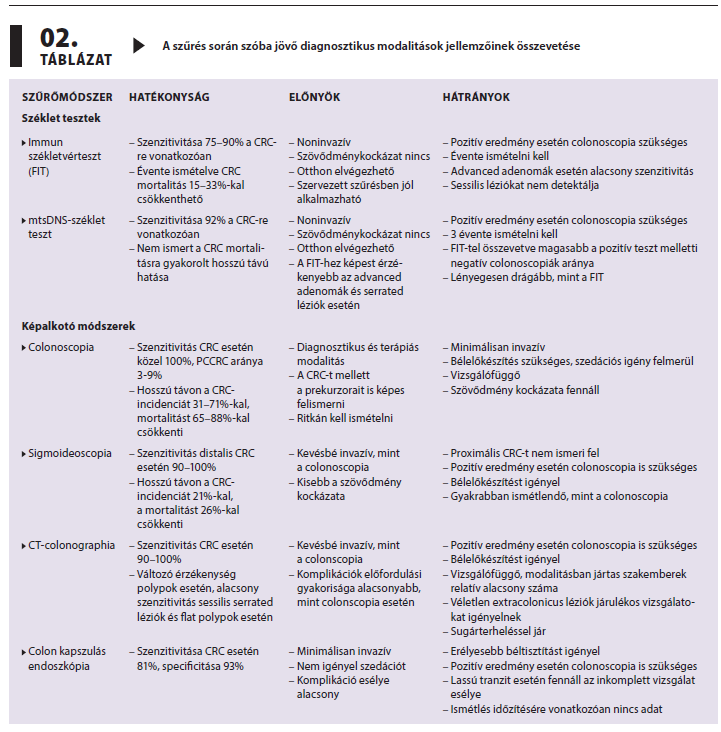
Az ideális szűrőmódszer noninvazív, a CRC-re és prekurzoraira vonatkozóan, beleértve a korai carcinomákat, az advanced adenomákat és a sessilis serrated léziókat is, magas szenzitivitással és specificitással rendelkezik, biztonságos, olcsó, könnyen hozzáférhető és a beteg számára nem megterhelő. Ennek a követelménynek jelenleg egyetlen modalitás sem felel meg, de érzékenységére és az egyidejűleg fennálló terápiás lehetőségre tekintettel a colonoscopia jelenti az arany standardot. A szűrésre potenciálisan alkalmas vizsgálómódszerek jellemzőit a 2. táblázat foglalja össze. Az American College of Gastroenterology (ACG) 2021-ben publikált, valamint a három szakmai szervezetet, az American Gastroenterological Associationt (AGA), az American Society for Gastrointestinal Endoscopyt (ASGE) és az ACG-t tömörítő U.S. Multi-Society Task Force on Colorectal Cancer (USMSTF) 2022-ben közzétett irányelve az egylépcsős, (direkt) colonoscopia alapú és a kétlépcsős (indirekt), FIT-en és colonoscopián alapuló populációs szintű szűrőprogram bevezetését javasolja.4,5
A legtöbb országban a kétlépcsős szűrőprogram került bevezetésre. Ez alól kivételt Németország és az Amerikai Egyesült Államok (USA) képez, ahol választási lehetőséget kínálnak a résztvevőknek, de preferált a direkt szűrést. A kétlépcsős program hátránya, hogy a FIT évenkénti-kétévenkénti ismétlését igényli, valamint hatékonyságának alapfeltétele a betegnek a programhoz való jó perzisztens adherenciája. Bár erős rendszeralapú háttértámogatást igényel, úgy tűnik, ez alkalmazható leghatékonyabban a populációs szintű szűrésre. Ennek egyik oka, hogy kevésbé terheli meg az ellátórendszert, a direkt szűrés, mivel a populáció adekvát átszűréséhez a FIT-nek köszönhetően 90%-kal kevesebb colonoscopia szükséges. Emellett a betegek szűrési adherenciája és a colonoscopia elfogadási rátája a noninvazív első lépcsőnek köszönhetően javul. A 2. táblázatban bemutatott és irányelvekben definiált alternatív szűrési módszereket, úgymint a CT-colonographiát vagy colon kapszulás endoszkópiát a szűrőprogramok döntő többsége nem támogatja. Ennek főként költséghatékonysági és infrastrukturális okai vannak, ugyanis a vizsgálatok pozitív eredményei szükségessé teszik a colonscopia elvégzését is, ami szűrt populációban tapasztalt 50% feletti polyp-detekciós rátát figyelembe véve jelentős extra költséget generál. Ezek a modalitások csak azon betegek számára jelenthetnek alternatívát, akiknél nincs mód vagy akik nem alkalmasak a colonoscopiára, illetve inkomplett vizsgálat volt csak kivitelezhető.
Az International Agency for Research on Cancer meghatározása szerint a szervezett szűrőprogramtól elvárt, hogy rendelkezzen jól definiált szabályzattal, ami meghatározza a szűrés korcsoportjait, a módszerét és az időközét, ezáltal csak a meghatározott célpopulációt vizsgálja. Rendelkezzen végrehajtásért felelős irányító szervvel, valamint a szakmai döntésekért és az ellátásért felelős egészségügyi szakmai tanácsadó csoporttal, továbbá minőségbiztosítási struktúrával. A szervezett szűrés előnye, hogy védelmet nyújt a páciensek számára a szűrési hibákkal szemben, beleértve a szűrés túl gyakori, túl ritka, illetve helytelen alkalmazását, továbbá a szűrés lépcsőinek rendszeres teljesítménykontrollja lehetővé teszi a minőségbiztosítást. A szűrés túl ritka alkalmazásáról akkor beszélünk, ha a szűrésre kötelezettek nem kerülnek meghívásra a programba, a daganat családi halmozódása miatti emelkedett rizikót figyelmen kívül hagyva ajánlják fel számukra a szűrést (pl. colonoscopia helyett FIT a magasabb CRC-rizikó esetén, nem megfelelő életkorban való kezdés, vagy nem optimális ellenőrzési gyakoriság stb.). „Túlszűrésről” akkor beszélünk, ha az esedékes ellenőrző időintervallumon belül a beteg hamarabb kerül ismét a szűrés rendszerébe, feleslegesen téve ki őt az invazív vizsgálat kockázatainak. A szűrés helytelen alkalmazásának tekintjük, ha úgy kerül elvégzésre, amely már nem tudja meghozni a tőle várt előnyöket, például olyan személynek kínálják fel, akinél nem lenne indokolt (pl. 45 évnél fiatalabb általános rizikójú személy, 85 évnél idősebbek stb.), vagy ismétlésre kerül a FIT a megelőző pozitív eredmény után ahelyett, hogy colonoscopiára kerülne sor. A megfelelő szakmai kontroll mellett végzett szervezett szűréseknél ezen hibák kiküszöbölhetők, azonosíthatók az inadekvát protokollt követő ellátó(helye)k.
Hazánkban 2018-ban indult el a populációs szintű, kétlépcsős vastagbél-szűrőprogram (azonosító szám: EFOP-1.8.1-VEKOP-15-2016-00001) az első meg-hívólevelek kiküldésével, majd 2019-ben került sor az első colonoscopiára. A programba a CRC szempontjából általános kockázatú, 50 és 70 év közötti páciensek kerülnek meghívásra, akik a megelőző két évben colonoscopián és 6 hónapon belül FIT elvégzésén nem estek át az egészségügyi nyilvántartási rendszer adatai alapján, továbbá fekvőbeteg-ellátásra sem került sor a vastagbél bármely szakaszának rosszindulatú daganata (BNO C1800-C1890, C19H0, C20H0) és/vagy gyulladásos bélbetegség (BNO K5000-K5090, K5180-K5190) diagnózisa miatt a megelőző 5 évben. A kétlépcsős szűrőprogram során az első lépcsőben két FIT elvégzésére kerül sor, majd ennek nem negatív eredménye esetén válnak jogosulttá a páciensek a colonoscopiára. A háziorvosok és az intézmények endoszkópos egységeinek programhoz való csatlakozása önkéntes. A csatlakozni kívánó egységeknek jól definiált tárgyi és személyi feltételeknek kell megfelelniük a szűrés minőségének biztosítása érdekében, így csatlakozásuk előtt ellenőrzésen, auditon esnek át.
A CRC magasabb kockázata genetikai fogékonyság következménye, mely az esetek legnagyobb részében polygénes öröklésmenetet mutató mutációk következménye, és mindössze az összes CRC 1-5%-át teszik ki a monogénes öröklésmenetet mutató daganatok. A fokozott rizikójú egyének azonosítása ez alapján az adekvátan felvett családi anamnézis alapján lehetséges, ritkább esetben az endoszkópos kép alapján merül fel polyposis szindróma lehetősége. A pozitív családi anamnézissel rendelkező egyének CRC-szűrése eltér az általános rizikójú egyének szűrésétől, a hagyományos protokollt követve elmaradnak a szűréstől várt egyéni és populációs szinten várt előnyök. Az összes irányelv emelkedett kockázatúnak tekinti a pácienst CRC szempontjából, ha van legalább egy CRC-vel érintett elsőfokú hozzátartozója, és esetében a szűrés megkezdését 40 éves kortól, vagy a CRC-vel érintett hozzátartozó diagnóziskori életkoránál 10 évvel hamarabb javasolja, és esetükben megelőző FIT nélkül primer colonoscopia szükséges, 5-10 évente ismételve. Az elsőfokú hozzátartozónál kialakult advanced adenoma előfordulása esetén a legtöbb irányelv a CRC-szűrést 40 éves kortól vagy 10 évvel az adenoma legkorábbi diagnózisa előtt javasolja FIT vagy colonoscopia alkalmazásával. Az ACG és USMSTF irányelve figyelembe veszi a hozzátartozó CRC és advanced adenoma felfedezéskori életkorát is: 60 évnél fiatalabb hozzátartozó esetén colonoscopiás szűrést javasolnak, míg 60 évnél idősebb hozzátartozó esetén a FIT-szűrést is elegendőnek találják. A magyarországi szervezett populációs szűrőprogram fokozott CRC-rizikójú személyekre vonatkozó protokollját a 3. táblázat foglalja össze.
POST-POLYPECTOMIÁS KÖVETÉSRE VONATKOZÓ IRÁNYELVEK
A polypok formájában megjelenő adenomák a vastagbél-nyálkahártyából kiinduló benignus, daganatos elváltozások, amelyek premalignus lézióként a CRC előfutárainak tekinthetők. A polypectomiát követően kialakuló metachron adenomák és a CRC kockázatát a detektált és eltávolított polyp mérete, morfológiai jegyei, szövettani típusa és abszolút száma határozza meg. A post-polypectomiás endoszkópos követés célja emiatt a CRC incidenciájának és mortalitásának csökkentése az indexvizsgálatnál fel nem ismert („missed léziók”) és újonnan kialakult polypok eltávolításával az ellenőrző vizsgálat során.6
 A post-polypectomiás követésre vonatkozóan 2020-ban jelent meg az European Society of Gastrointestinal Endoscopy (ESGE), az USMSTF és a brit irányelv egyaránt, amelyek célja az index colonoscopia után a betegek megfelelő követési stratégiájának meghatározása, egyensúlyt teremtve a daganatos betegség kialakulásának kockázata, a colonoscopia okozta egyént érintő teher és kockázat, továbbá a költséghatékonysági szempontok között.7–9 Az iránymutatások frissítését a polypectomiát követő hosszú távú CRC előfordulására és a halálozására vonatkozó új adatok megjelenése tette szükségessé.
A post-polypectomiás követésre vonatkozóan 2020-ban jelent meg az European Society of Gastrointestinal Endoscopy (ESGE), az USMSTF és a brit irányelv egyaránt, amelyek célja az index colonoscopia után a betegek megfelelő követési stratégiájának meghatározása, egyensúlyt teremtve a daganatos betegség kialakulásának kockázata, a colonoscopia okozta egyént érintő teher és kockázat, továbbá a költséghatékonysági szempontok között.7–9 Az iránymutatások frissítését a polypectomiát követő hosszú távú CRC előfordulására és a halálozására vonatkozó új adatok megjelenése tette szükségessé.
A három irányelv eltérő definíciókat alkalmaz, emiatt a 4. táblázatban a definíciók, kategóriák jelölése nélkül, a polypok száma, mérete és szövettana alapján vetjük össze az irányelvek javaslatait. Az USMSTF-irányelv alacsony (< 10 mm, low-grade dysplasiát mutató ≤ 2 tubularis adenoma) és magas (≥ 10 mm és/vagy high grade dysplasiát mutató és/vagy villosus/ tubulovillosus) kockázatú adenomákat különít el. Az ESGE-irányelv követést igénylő és nem igénylő polypokról beszél. Eszerint szükségtelen a post-polypectomiás követése azon betegeknek, akiknél szövettani típustól függetlenül kevesebb, mint 4 polyp igazolódik, amelyek mérete nem éri el a 10 mm-t és konvencionális adenoma esetén low-grade dysplasiát mutat, vagy sessilis serrated lézió esetén nem jár dysplasiával. Ha bármely tényezőben eltérés mutatkozik, indokolt a követése a szűrőprogramon kívül. A BSG/ACPGBI/PHE-irányelv a „premalignus polyp” kifejezést használja, amivel a malignizációs potenciállal rendelkező polypokat, azaz a serrated és adenomatosus polypokat jelöli, továbbá ezen belül elkülönít egy magas kockázatú alcsoportot. Ezt úgy határozza meg, mint ≥ 2 premalignus polyp, amelyek közül legalább egy ≥ 10 mm-es vagy dysplasiával rendelkező serrated polyp, vagy ≥ 10 mm-es konvencionális adenoma vagy high-grade dysplasiával rendelkező adenoma. Magas rizikóként jelöli meg továbbá az ≥ 5 premalignus polyp detektálását is. Az advanced adenoma definíciója sem egységes az irányelvekben. Míg az ESGE és a BSG/ ACPGBI/PHE irányelve egyaránt a 10 mm-t meghaladó és/vagy high-grade dysplasiát (HGD) mutató adenomákat sorolja ide, addig az USMSTF irányelve belefoglalja ebbe a kategóriába a tubulovillosus és villosus adenomákat is. A brit irányelv emellett külön tárgyalja a sessilis serrated léziókat (SSL) a konvencionális adenomáktól eltérő tulajdonságaik miatt, és advanced adenomának tekint minden dysplasiával rendelkező 10 mm-t meghaladó méretű SSL-t.
Úgyszintén újdonság a három irányelvben, hogy kitérnek a post-polypectomiás utánkövetés kapcsán a páciens életkorára is. Az ESGE 80 éves korban vagy korábban javasolja a követés felfüggesztését a várható élettartamot jelentősen korlátozó a társbetegségek esetén. Ehhez hasonlóan a BSG/ACPGBI/PHE is tanácsolja a leállítását az 75 évesnél idősebb betegek vagy a várható élettartamukat 10 évnél kevesebbre korlátozó társbetegségben szenvedő betegek esetében. Az USMSTF kevésbé egyértelműen foglal állást, mérlegelendőnek találja a felfüggesztését 75 év felett, de kiemelik, hogy több kutatásra van szükség a CRC szempontjából a haszon-kockázat mérlegeléséhez.
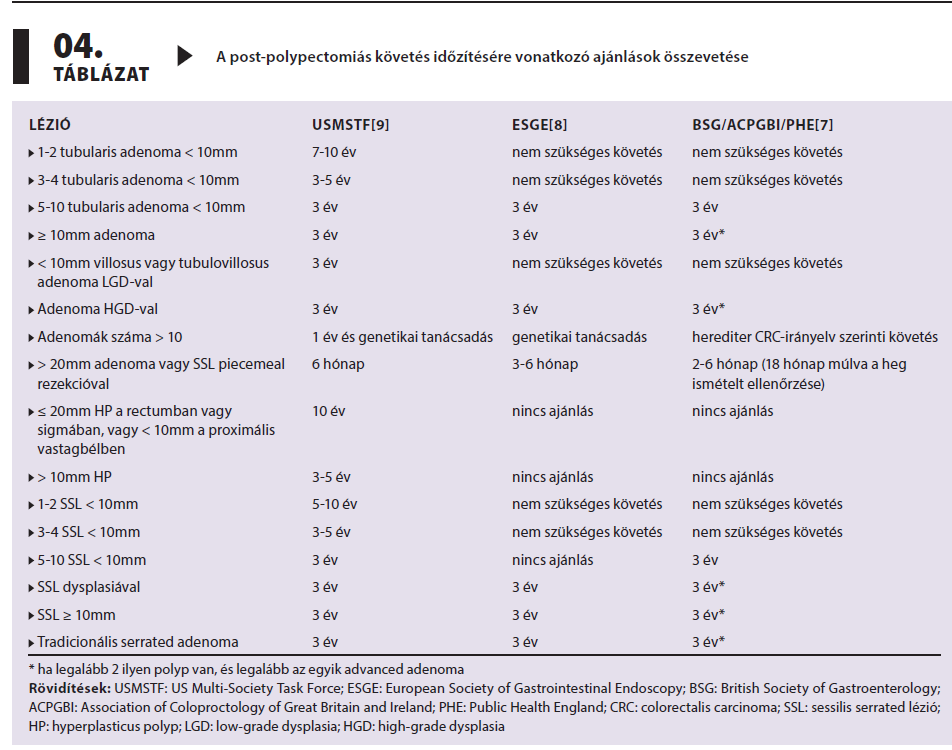
Az előzőkből is kitűnik, hogy az USMSTF irányelve a legkonzervatívabb, a másik két irányelv nemcsak meghosszabbította a 4-nél kevesebb 10 mm-t el nem érő polyp ellenőrzéséig eltelő intervallumot, de javasolta ezen betegek visszavételét a szűrőprogramba. Ennek oka, hogy több tanulmány szerint a CRC incidenciája és mortalitása alacsonyabb vagy közel megegyezik a népesség átlagos kockázatával.
A villosus és tubulovillosus szövettani típus mint magas kockázati tényező figyelembevételében mutatkozik további különbség az irányelvek között. Ennek oka, hogy az újabb tanulmányok rávilágítottak: ezek önmagukban nem emelték a CRC-incidenciát és -mortalitást hosszú távon. Ritkán fordulnak elő 10 mm-nél kisebb polypokban, és a kis léziók esetén a patológusok között a villosus szerkezet megítélésénél kicsi az egyetértés, azaz kimagasló az interobserver variabilitás. Szintén jelentősen eltér az USMSTF irányelvének ellenőrzési intervalluma az európai irányelvekétől a hyperplasticus polypok és sessilis serrated léziók (SSL) esetében.
Az irányelvek közötti eltérés elsősorban a nemzetközi adatok összevetésében, értelmezésében jelenthet a továbbiakban nehézséget, és a gyakorló gasztroenterológusok számára nagyobb szabadságot ad a post-polypectomiás követés időzítésének megtervezésénél. Az eltérő irányelvek követése akár egy munkahelyen dolgozó endoszkópos orvosok esetében is megmutatkozhat. Kiemelendő ugyanakkor, hogy számos tanulmány hívja fel a figyelmet az irányelvekhez való alacsony adherenciára, amihez az orvosi, illetve páciensi oldalról adódó tényezők egyaránt hozzájárulnak. Egy 16 országból származó tanulmányokat elemző metaanalízis a post-polypectomiás követés irányelvéhez való adherenciát 48,4%-nak találta, ezen belül 24,4% volt az alacsony, míg 73,6% volt a magas kockázatú léziók esetén.10 Az irányelvek be nem tartása számos tényezővel függhet össze, amelyek közül az orvos oldaláról szóba jön az ajánlásokkal vagy klinikai vizsgálatokkal való egyet nem értés, a hosszú utánkövetési idő esetén a tévedésből adódó felelősségre vonástól való félelem, a betegek faji hovatartozása, az erőforrások elérhetetlensége vagy a bélelőkészítés minősége („missed léziótól” való félelem). Az utolsóként említett tényező azért is kiemelten fontos, mert az irányelvek a „minőségi endoszkópia” esetére vonatkoznak, amelynek során megfelelő minőségben történt meg a vastagbél egészének áttekintése és a felismert léziók ellátása, eltávolításuka során követték a terápiás protokollokat.
Az iránymutatásoktól való eltérés az egyén szempontjából, népegészségügyi szempontból és költséghatékonysági, infrastrukturális szempontból lényeges hatást fejt ki akár rövidebb, akár hosszabb intervallumot választanak. Az egyén oldalán a gyakori ellenőrzés megterhelést, költséget jelenthet, és feleslegesen teszi ki az invazív vizsgálat kockázatainak, míg a túl hosszú időnként végzett ellenőrzés a CRC-kockázat emelkedésével jár. Az ellátórendszer oldaláról a rendszer leterheltségének növekedéséhez, a várólisták hosszának megnyúlásához és az ellátási költség emelkedéséhez vezethet. A nem megfelelő utánkövetési stratégia a tanulmányok által kalkulált népegészségi haszon, a CRC incidenciára és mortalitásra gyakorolt pozitív hatásának elmaradásával fenyeget.
ÖSSZEFOGLALÁS
A populációs szintű CRC-szűrésre vonatkozóan több, alapjaiban megegyező irányelv áll rendelkezésre döntően az USA területéről, amelyek 50–75 éves populáció esetén javasolják az elvégzését egylépcsős direkt colonoscopos vagy kétlépcsős, FIT-es és colonoscopián alapuló módszerrel. Kiterjesztését 45–49 éves, illetve válogatott esetben 85 éves korig mérlegelik. Az alternatív szűrőmódszereket csak másodlagos, alternatív módszerként tárgyalják. Magyarországon a 2018-ban bevezetett populációs szintű szűrőprogram szakmai protokolljának követése szükséges, ami korrelál a tárgyalt irányelvekkel.
Több nemzetközi ajánlás áll rendelkezésre a post-polypectomiás követésre vonatkozóan, amelyek alapjaiban hasonlók, de részleteiben eltérést mutatnak, elsősorban a 4-nél kevesebb 10 mm-es polypok, SSL-k és villosus/tubulovillosus szövettani típus esetén. Mivel az utánkövetési intervallumok eltérést mutatnak, a választott irányelvtől függően eltérő terhelést jelentenek az endoszkópos ellátórendszerre. Sürgető lenne ezért a magyar szakmai ajánlás kidolgozása az egységes utánkövetési protokoll miatt mind szakmai, mind betegbiztonsági tényezők szempontjából.
Nyilatkozat. A közlemény más folyóiratban korábban nem jelent meg, és nem került beküldésre. A szerzők a cikk megírása, illetve a kutatómunka során anyagi támogatásban nem részesültek. A szerzőknek a cikk témájával kapcsolatos érdekeltsége nincs. A dolgozat nem sérti a Helsinki deklaráció előírásait.
Levelezési cím:
This e-mail address is being protected from spambots. You need JavaScript enabled to view it.
This e-mail address is being protected from spambots. You need JavaScript enabled to view it.
Irodalom:
1. Sung H, Ferlay J, Siegel RL, et al. Global Cancer Statistics 2020: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries. CA Cancer J Clin 2021;71(3):209–49.
2. Zauber AG, Winawer SJ, O’Brien MJ, et al. Colonoscopic Polypectomy and Long-Term Prevention of Colorectal- Cancer Deaths. New England Journal of Medicine 2012; 366(8):687–696.
3. Levin TR, Corley DA, Jensen CD, et al. Effects of Organized Colorectal Cancer Screening on Cancer Incidence and Mortality in a Large Community-Based Population. Gastroenterology 2018;155(5):1383–1391.e5.
4. Shaukat A, Kahi CJ, Burke CA, et al. ACG Clinical Guidelines: Colorectal Cancer Screening 2021. Am J Gastroenterol 2021;116(3):458–479.
5. Patel SG, May FP, Anderson JC, et al. Updates on Age to Start and Stop Colorectal Cancer Screening: Recommendations From the U.S. Multi-Society Task Force on Colorectal Cancer. Am J Gastroenterol 2022;117(1):57–69.
6. Abu-Freha N, Katz LH, Kariv R, et al. Post-polypectomy surveillance colonoscopy: Comparison of the updated guidelines. United European Gastroenterol J 2021;9(6): 681.
7. Rutter MD, East J, Rees CJ, et al. British Society of Gastroenterology/Association of Coloproctology of Great Britain and Ireland/Public Health England post-polypectomy and post-colorectal cancer resection surveillance guidelines. Gut 2020;69(2):201–223.
8. Hassan C, Antonelli G, Dumonceau JM, et al. Post-polypectomy colonoscopy surveillance: European Society of Gastrointestinal Endoscopy (ESGE) Guideline - Update 2020. Endoscopy 2020; 52(8):687–700.
9. Gupta S, Lieberman D, Anderson JC, et al. Recommendations for Follow-Up After Colonoscopy and Polypectomy: A Consensus Update by the US Multi-Society Task Force on Colorectal Cancer. Gastroenterology 2020;158(4):1131-1153.e5.
10. Abu Freha N, Abu Tailakh M, Elkrinawi J, et al. Post-polypectomy surveillance colonoscopy: are we following the guidelines? Int J Colorectal Dis 2020;35(7):1343–1346.
11. Davidson KW, Barry MJ, Mangione CM, et al. Screening for Colorectal Cancer: US Preventive Services Task Force Recommendation Statement. JAMA 2021;325(19):1965–1977.
a szerző cikkei
Dr. Szepes Zoltán , Belgyógyász, gasztroenterológus, egyetemi docens, Szegedi Tudományegyetem, Szent-Györgyi Albert Klinikai Központ, Belgyógyászati Klinikai, Gasztroenterológiai Centrum
a szerző cikkei











