Guillain–Barré-szindróma
A Guillain–Barré-szindróma és variánsai egy heterogén, akut neurológiai betegségcsoport. Patomechanizmusuk összetett és nem egyértelműen tisztázott. A diagnózist a klinikai tünetek, az akut neurológiai tüneteket megelőző infekció, a liquor-vizsgálat és az elektroneurográfia segítségével állapítjuk meg. Rendelkezésre áll evidenciákon alapuló immunmoduláns kezelés, amit javasolt mielőbb elkezdeni; az IVIG és a plazmaferezis hatékonyságát számos klinikai vizsgálat igazolja. A betegség korai felismerése és kezelése, valamint a szövődmények gyors észlelése és ellátása meghatározza a hosszú távú kimenetelt. A prognózis összességében jó, de számos beteg gyógyul maradványtünetekkel.
BEVEZETÉS
 A ma Guillain–Barré-szindróma (GBS) néven emlegetett kórkép első tünettani leírása 1859-re nyúlik vissza és Jean Baptiste Octave Landry nevéhez fűződik. Az általa megfigyelt „akut aszcendáló paresis”, areflexia és szenzoros tünetek kísérte betegség különálló entitásként 1916-ban a George Guillain, Jean-Alexandre Barré és André Strohl által írt esetközlések révén vonult be a szakirodalomba. E három neurológus vette észre, hogy a betegek liquorában a fehérjekoncentráció megemelkedik, míg a fehérvérsejtszám normális marad („dissociation albumino-cytologique”) – ez megkülönböztette e szindrómát az egyéb, infekciókhoz társuló flaccid paresistől.1
A ma Guillain–Barré-szindróma (GBS) néven emlegetett kórkép első tünettani leírása 1859-re nyúlik vissza és Jean Baptiste Octave Landry nevéhez fűződik. Az általa megfigyelt „akut aszcendáló paresis”, areflexia és szenzoros tünetek kísérte betegség különálló entitásként 1916-ban a George Guillain, Jean-Alexandre Barré és André Strohl által írt esetközlések révén vonult be a szakirodalomba. E három neurológus vette észre, hogy a betegek liquorában a fehérjekoncentráció megemelkedik, míg a fehérvérsejtszám normális marad („dissociation albumino-cytologique”) – ez megkülönböztette e szindrómát az egyéb, infekciókhoz társuló flaccid paresistől.1
A GBS előfordulása világviszonylatban nem pontosan ismert. A legtöbb epidemiológiai adat Észak-Amerikából és Európából származik, ezek alapján az éves incidencia a felnőtt populációra vetítve 1-2/100 000 főre becsülhető. A gyakoriság az életkor előrehaladtával növekszik, évtizedenként körülbelül 20%-kal. A nemek aránya nem kiegyenlített, a férfiaké enyhén meghaladja a nőkét. Az előfordulás földrajzi régiónként is változik, ebben genetikai tényezők mellett mikroorganizmus-törzsek különböző elterjedési mintázata játszhat szerepet. Bizonyos járványok után az incidencia növekedését figyelték meg.2,3
ETIOLÓGIA ÉS PATOMECHANIZMUS
 Az esetek közel kétharmadában az első tüneteket kevesebb mint négy héttel megelőző gasztrointesztinális vagy felső légúti infekció szerepel a betegek anamnézisében. Számos mikroorganizmust azonosítottak, amelyek szerepet játszhatnak a betegség kialakulásában. A baktériumok közül a Campylobacter jejuni emelendő ki, amely hozzávetőleg 25%-ban áll a GBS hátterében. A kórkép összefüggésbe hozható még a Haemophilus influenzae, Mycoplasma pneumoniae baktériumokkal, Epstein–Barr (EBV), Cytomegalo- (CMV), hepatitis E vírusokkal is. Továbbá, a közelmúltban zajlott endémiák hívták fel a figyelmet a Zika vírus etiológiai szerepére. Hasonlóképpen, a COVID-19-pandémia során észlelt esetek felvetik a SARS-CoV-2 kóroki voltának lehetőségét, azonban ezzel kapcsolatban ellentmondóak az adatok.2,4
Az esetek közel kétharmadában az első tüneteket kevesebb mint négy héttel megelőző gasztrointesztinális vagy felső légúti infekció szerepel a betegek anamnézisében. Számos mikroorganizmust azonosítottak, amelyek szerepet játszhatnak a betegség kialakulásában. A baktériumok közül a Campylobacter jejuni emelendő ki, amely hozzávetőleg 25%-ban áll a GBS hátterében. A kórkép összefüggésbe hozható még a Haemophilus influenzae, Mycoplasma pneumoniae baktériumokkal, Epstein–Barr (EBV), Cytomegalo- (CMV), hepatitis E vírusokkal is. Továbbá, a közelmúltban zajlott endémiák hívták fel a figyelmet a Zika vírus etiológiai szerepére. Hasonlóképpen, a COVID-19-pandémia során észlelt esetek felvetik a SARS-CoV-2 kóroki voltának lehetőségét, azonban ezzel kapcsolatban ellentmondóak az adatok.2,4
A mikroorganizmusokon túl, vakcinációkat követően megfigyelt gyakoribb megbetegedések alapján számos oltóanyag esetén felmerült a gyanú azok potenciális rizikóemelő hatásával kapcsolatban. Bizonyított, számottevő esetszám-emelkedést és ok-okozati kapcsolatot azonban csak az Egyesült Államokban, 1976-ban zajlott H1N1-járvány alkalmával beadott, illetve néhány korábbi rabies vakcinával kapcsolatban sikerült igazolni. Az influenzaoltásokkal kapcsolatban egyértelműen megállapítható, hogy a vakcináció kevésbé emeli a GBS kockázatát, mint maga a megelőzni kívánt infekció2,3 (1. táblázat).
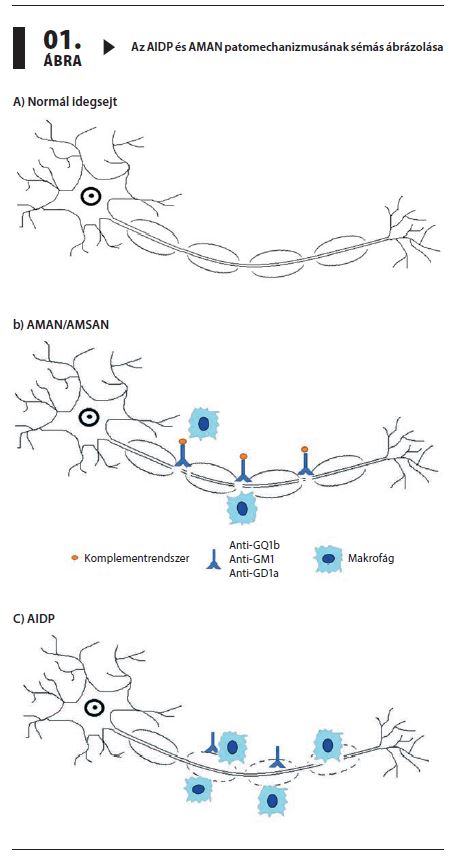 A Campylobacter-speciesekkel asszociált esetek gyakrabban primer axonkárosodással és súlyosabb prognózissal járnak. Az axonális variánsok patogenezise jól tisztázottnak látszik, középpontjukban a molekuláris mimikri áll. Ennek lényege, hogy bizonyos Campylobacter jejuni-törzsek sejtfalában található lipooligoszacharidok (LOS) az axolemmát alkotó glikolipidekkel (gangliozid GM1, GD1a, GQ1b) azonos epitópokat tartalmaznak, s így a humorális immunválasz során ellenük képződő specifikus antitestek a Ranvier-befűződések (nodiumok) membránjával keresztreagálnak. A kitapadó antitestek egy részről a kálium-és nátriumcsatornák áteresztőképességének megváltoztatása révén kondukciós blokkot, más részről komplementaktivációt és következményes makrofáginváziót idéznek elő. Az immunreakció mértékétől függ, hogy reverzibilis vezetési zavar vagy teljes axonmegszakadás, majd Waller-féle degeneráció révén kiterjedt axonpusztulás jön létre, ami nagyrészt irreverzibilis. Az Európában elterjedt akut gyulladásos demielinizációs polyneuropathia (AIDP), illetve a távol-keleti országokban dominálóan előforduló akut motoros axonális neuropathia/akut motoros és szenzoros axonális neuropathia (AMAN/AMSAN) eltérő földrajzi előfordulása nem magyarázható csupán a baktériumtörzsek különböző eloszlásával. Úgy tűnik, hogy az autoreaktív antitestképződés csak az arra „fogékony” egyénekben alakul ki.2,5
A Campylobacter-speciesekkel asszociált esetek gyakrabban primer axonkárosodással és súlyosabb prognózissal járnak. Az axonális variánsok patogenezise jól tisztázottnak látszik, középpontjukban a molekuláris mimikri áll. Ennek lényege, hogy bizonyos Campylobacter jejuni-törzsek sejtfalában található lipooligoszacharidok (LOS) az axolemmát alkotó glikolipidekkel (gangliozid GM1, GD1a, GQ1b) azonos epitópokat tartalmaznak, s így a humorális immunválasz során ellenük képződő specifikus antitestek a Ranvier-befűződések (nodiumok) membránjával keresztreagálnak. A kitapadó antitestek egy részről a kálium-és nátriumcsatornák áteresztőképességének megváltoztatása révén kondukciós blokkot, más részről komplementaktivációt és következményes makrofáginváziót idéznek elő. Az immunreakció mértékétől függ, hogy reverzibilis vezetési zavar vagy teljes axonmegszakadás, majd Waller-féle degeneráció révén kiterjedt axonpusztulás jön létre, ami nagyrészt irreverzibilis. Az Európában elterjedt akut gyulladásos demielinizációs polyneuropathia (AIDP), illetve a távol-keleti országokban dominálóan előforduló akut motoros axonális neuropathia/akut motoros és szenzoros axonális neuropathia (AMAN/AMSAN) eltérő földrajzi előfordulása nem magyarázható csupán a baktériumtörzsek különböző eloszlásával. Úgy tűnik, hogy az autoreaktív antitestképződés csak az arra „fogékony” egyénekben alakul ki.2,5
A kórkép másik fő típusában, az AIDP-ben elsődlegesen a Schwann-sejtek károsodnak, szegmentális demielinizáció alakul ki, az axonkárosodás járulékos, mértéke variábilis. Itt a patomechanizmus kevésbé tisztázott. Bár számos mielin-struktúrfehérje (pl. P2, P0, PMP22 proteinek, illetve a paranodalis elhelyezkedésű meosin vagy neurofascin) és membrán glikolipid autoantigén szerepe e variánsnál is felmerült, specifikus autoantitestek jelenléte sokszor nem igazolható, és azok kóroki szerepe nem egyértelmű. A hisztológiai tanulmányok arra utalnak, hogy a korai fázisban jelentősebb szerepet kap a sejtes immunválasz, mint AMAN-ban. Karakterisztikus eltérés az endoneurialis teret kitöltő limfocitás beszűrődés, a lamina basalist átlépő, mielint leválasztó makrofágok jelenléte, valamint a Schwann-sejtek vacuolaris degenerációja.6
Az AIDP és AMAN patomechanizmusát sémásan a 1. ábrán foglaljuk össze.
KLINIKAI MEGJELENÉS
Típusos klinikai kép
A központi idegrendszer érintettségének hiánya mellett kialakuló, rapidan progrediáló kétoldali alsó és/vagy felső végtagi gyengeség esetén a GBS gyanúja minden esetben felmerül.
A GBS klasszikus szenzomotoros formájára, az AIDP-re jellemző a disztálisan megjelenő érzészavarhoz társuló végtaggyengeség. A paresis jellegzetesen az alsó végtagokban kezdődik, majd felszálló gyengeség formájában terjed tovább a felső végtagokra, illetve a cranialis izomzatra. Az ínreflexek renyhék vagy kiesettek. Gyakran jelentkezik dysautonomia, vérnyomás-ingadozás, aritmia, pupilla-funkciózavar, vizeletürítési zavar és paralyticus ileus képében. A gyakran megjelenő fájdalom lehet mind izom-, mind radicularis, mind neuropathiás jellegű. A GBS monofázisos betegség, kezdete akut vagy szubakut, a mozgáskorlátozottság két héten belül kialakul. A progresszív fázisban a betegek 20–30%-ánál jelentkezik légzési elégtelenség.2,7
Atípusos klinikai megjelenés
A GBS atípusos tünetekkel is jelentkezhet. Ilyen esetekben a kétoldali gyengeség és a szenzoros tünetek aszimmetrikusan, túlnyomórészt proximálisan vagy disztálisan, bármely végtagon megjelenhetnek egyidejűleg. Továbbá súlyos diffúz fájdalom vagy izolált agyidegbénulás is jelezheti a betegséget.2
Speciális variánsok
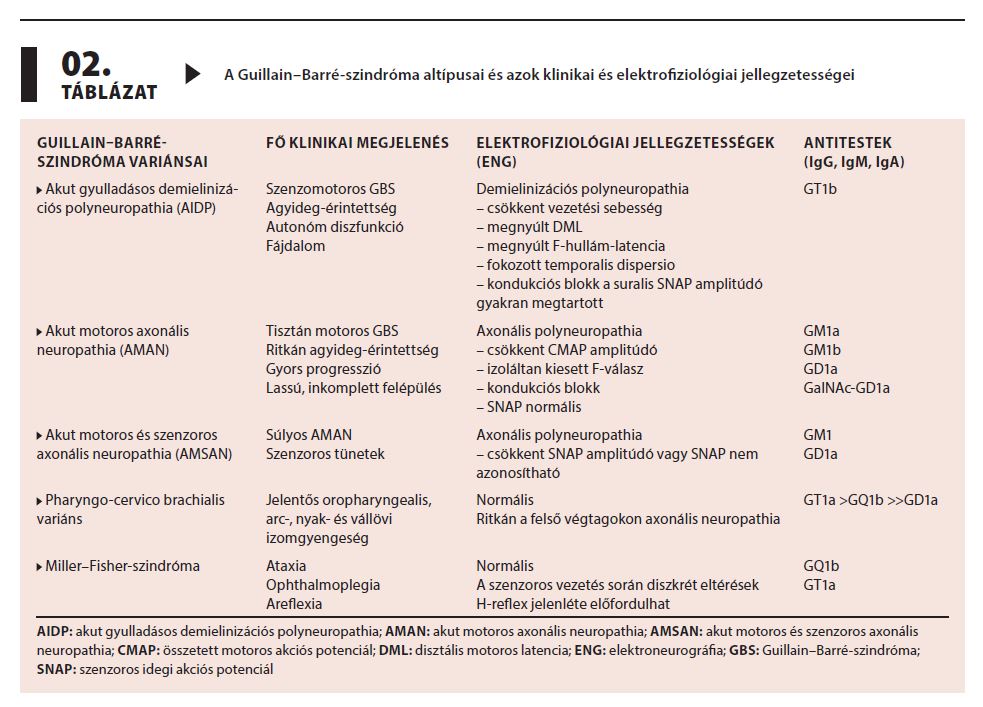
A GBS számos altípusa ismert, amelyek a klinikai, elektrofiziológiai és szövettani megjelenésükben különböznek (2. táblázat).8
DIAGNOSZTIKA
Megfelelő szenzitivitású és specificitású biomarkerek hiányában a jellegzetes klinikai tünetekre és jelekre alapozott a diagnózis, kiegészítő diagnosztikus vizsgálómódszerekkel lehet támogatni. A Brighton-féle kritériumrendszer használatával meghatározható a GBS diagnosztikus valószínűsége.7,9
Laboratóriumi vizsgálatok
Általános laboratóriumi vizsgálatok mellett a szérum IgG és IgM izotípusú gangliozid antitestek meghatározása támogathatja a feltételezett diagnózist. A Miller–Fisher-szindróma eseteinek 90%-ában igazolódik az anti-GQ1b antitestek jelenléte, illetve AMAN-ban gyakran észlelhetők az anti-GM1 és anti-GD1a IgG típusú antitestek (2. táblázat).10
Liquor-vizsgálat
GBS esetén fiziológiás sejtszám mellett emelkedett liquor-összfehérje-szintet látunk, amit fehérje–sejt disszociációnak hívunk. Mindazonáltal a liquor-összfehérje normális lehet az esetek 30–50%-ában az első héten, illetve 10–30%-ában a második héten.7
Emelkedett sejtszám (50/mm3-nél magasabb) esetén differenciáldiagnosztikai szempontból infektív, gyulladásos betegségek vagy leptomeningealis malignitás merül fel.
Elektrofiziológiai vizsgálatok
Az idegvezetéses vizsgálatok támogathatják a feltételezett diagnózist és differenciálhatnak a demielinizációs és az axonális formák között. A betegségkezdet első hetén gyakran fiziológiásak. Az idegvezetéses abnormalitások a betegség második hetén a legkifejezettebbek. Az egyes variánsokban észlelt jellegzetes eltéréseket a 2. táblázatban részletezzük.11
Képalkotó vizsgálatok
Az MR-vizsgálat nem része a GBS rutin diagnosztikájának, ugyanakkor a klinikai képhez igazított magasságban elvégzett gerinc MR-vizsgálat során igazolódott gyöki gadolíniumhalmozás megerősíti a diagnózist. Továbbá differenciáldiagnosztika szempontjából alkalmas a gerincvelői kompresszió vagy a myelitis transversa kizárására.
A perifériás idegek ultrahangvizsgálatával megnagyobbodott cervicalis ideggyökök igazolhatók már a betegség korai szakaszában.8
Differenciáldiagnózis
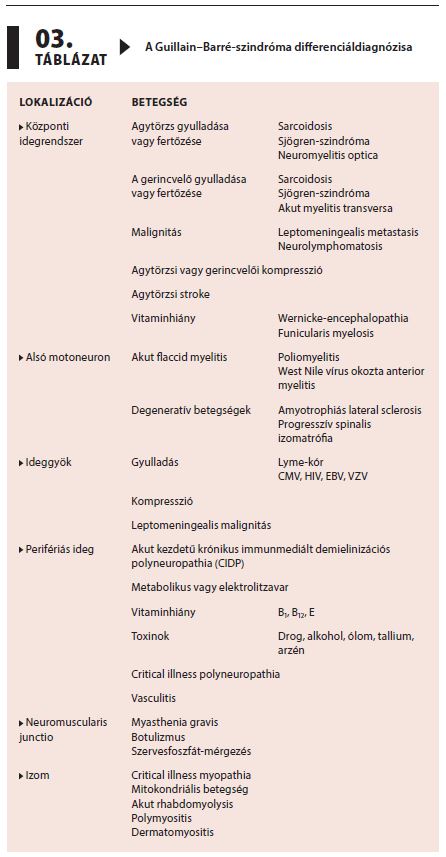
Amennyiben a mozgáskorlátozottság 24 órán belül vagy 4 héten túl alakul ki, továbbá más specifikus klinikai tünet vagy laboratóriumi eltérés is jelen van, egyéb diagnózisok megfontolása szükséges (3. táblázat).2,12
TERÁPIA
A betegek monitorozása
 A GBS sürgősségi neurológiai kórkép. Progressziója lehet gyors ütemű súlyos végtaggyengeséget, légzési elégtelenséget vagy autonóm diszfunkciót és kardiovaszkuláris szövődményeket előidéző állapot, ezért a diagnózis felállítása vagy alapos gyanúja esetén javasolt a beteg felvétele neurológiai osztályra és szoros megfigyelése, monitorozása. A légzési funkció monitorozására megfigyeljük a légzési segédizmok használatát, felmérjük meddig tud a beteg egy mély légvételt követően hangosan számolni. Emellett eszközösen ajánlott a vitálkapacitást, a maximális kilégzési és belégzési térfogatot mérni. Az izomerőt a nyakizmokban, a karokban és az alsó végtagokban a szokásos módon, skálák segítségével monitorozzuk. Emellett a köhögés és a nyelés erejét is ajánlott dokumentálni. A mozgáskorlátozottság értékelésére szolgál a GBS mozgáskorlátozottsági (disability) skála. Az autonóm funkciók monitorozása kiterjed a vérnyomás és pulzus mérésére, EKG-vizsgálatra, a vizelet-és székletretenció észlelésére. A betegek hozzávetőleg egyharmada igényel intenzív osztályos felvételt súlyos bulbaris tünetek vagy légzési elégtelenség kialakulása miatt.13
A GBS sürgősségi neurológiai kórkép. Progressziója lehet gyors ütemű súlyos végtaggyengeséget, légzési elégtelenséget vagy autonóm diszfunkciót és kardiovaszkuláris szövődményeket előidéző állapot, ezért a diagnózis felállítása vagy alapos gyanúja esetén javasolt a beteg felvétele neurológiai osztályra és szoros megfigyelése, monitorozása. A légzési funkció monitorozására megfigyeljük a légzési segédizmok használatát, felmérjük meddig tud a beteg egy mély légvételt követően hangosan számolni. Emellett eszközösen ajánlott a vitálkapacitást, a maximális kilégzési és belégzési térfogatot mérni. Az izomerőt a nyakizmokban, a karokban és az alsó végtagokban a szokásos módon, skálák segítségével monitorozzuk. Emellett a köhögés és a nyelés erejét is ajánlott dokumentálni. A mozgáskorlátozottság értékelésére szolgál a GBS mozgáskorlátozottsági (disability) skála. Az autonóm funkciók monitorozása kiterjed a vérnyomás és pulzus mérésére, EKG-vizsgálatra, a vizelet-és székletretenció észlelésére. A betegek hozzávetőleg egyharmada igényel intenzív osztályos felvételt súlyos bulbaris tünetek vagy légzési elégtelenség kialakulása miatt.13
Intenzív osztályos felvétel és légzéstámogatás
Intenzív osztályos felvételre a fokozódó légzési nehezítettség, a fenyegető légzési elégtelenség, a jelentős vérnyomás- és pulzusszám-ingadozással jellemezhető súlyos kardiovaszkuláris instabilitás, a dysphagia, vagy a gyenge köhögési reflex, valamint az izomgyengeség gyors progressziója esetén kerülhet sor, hozzávetőleg a betegek egyharmadánál. A fenyegető légzési elégtelenség klinikai jele lehet a nyugalomban vagy enyhe terhelésnél, mint például beszéd során megjelenő dyspnoe, a légzési segédizmok igénybevétele, a tachycardia és a tachypnoe. Egyszerű felmérése a fenyegető légzési elégtelenségnek, ha a beteg képtelen egy légvétellel 15-ig számolni. A klinikai jelek mellett fenyegető légzési elégtelenségre utal a hypoxia, pulzoximéterrel vagy a vérgázparaméterek alapján megállapítva.2 A „20/30/40-es szabály” szerint annál a betegnél, akinek vitálkapacitása kisebb mint 20 ml/kg, a maximális belégzési térfogata kisebb mint 30 cmH2O vagy a maximális kilégzési térfogata kisebb mint 40 cmH2O, fennáll a légzési elégtelenség kockázata.2
Az intubáció hypoxia, gyorsan hanyatló légzési funkció, gyenge köhögés vagy aspiráció gyanúja esetén válhat szükségessé, 15 ml/kg alatti FVC értékeknél.14 A betegek 22%-a igényel asszisztált lélegeztetést az első héten.2 Ennek kockázatát méri fel az Erasmus GBS légzési elégtelenség skála (EGRIS), amely 0 és 7 között pontozza a rizikót, az izomerő, a facialis és/vagy bulbaris paresis és a tünetek kezdete és a hospitalizációs igény között eltelt napok száma alapján; ahol a magasabb szám magasabb kockázatot képvisel. Tartósan fennálló légzési elégtelenség és légzéstámogatási igény esetén tracheostomia javasolt. Az axonvesztéses kórforma, a kiesett motoros válaszok ENG-vizsgálaton és a súlyos felső végtagi paresis az intubációt követően egy héttel képeznek magas rizikót a tartós lélegeztetési igényre és ilyenkor a korai tracheostomia megfontolandó.15
Immunmoduláns kezelés
Az immunmoduláns kezelésnek két alappillére az intravénás immunglobulin (IVIG) kezelés és a plazmaferezis, melyek a klinikai vizsgálatok tanúsága szerint egyenlő hatékonysággal rendelkeznek. Sem az intravénás, sem a per os kortikoszteroid terápia nem bizonyult hatékonynak, alkalmazása ezért nem ajánlott. Kevés vizsgálat történt immunszuppresszív szerekkel GBS-ben, és az ezzel kapcsolatos evidenciák gyengék.8,16
Az immunmoduláns kezelést javasolt minden betegnél elkezdeni, amennyiben képtelen önállóan 10 métert gyalogolni, és megfontolandó gyors progressziót mutató izomgyengeség, bulbaris tünetek, autonóm diszfunkció és légzési nehezítettség esetén. A klinikai vizsgálatok során az intravénás immunglobulint két héten belül, a plazmaferezist négy héten belül kezdték meg. Az ezt meghaladó betegségtartam után megkezdett immunterápiával kapcsolatban nem áll rendelkezésre megfelelő evidencia, de a mindennapi klinikai gyakorlatban az immunterápia minden beteg esetében megfontolandó a betegség kezdetétől eltelt idő, a tünetek súlyossága és a rosszabbodás üteme alapján és javasolt mielőbb elkezdeni, az idegszálak további károsodásának megelőzése céljából.2
• Plazmaferezis a GBS kezelésében. A plazmaferezist a nyolcvanas évek óta alkalmazzák GBS kezelésére. Eltávolítja a szérumból a patogén ellenanyagot, az immunkomplexeket és citotoxikus anyagokat, melynek eredményeképpen gyorsítja a javulást, lerövidíti a felépülés tartamát. Egy összesen 649 beteg kezelését elemző metaanalízis eredménye alapján a plazmaferezis gyorsítja a javulást, biztonságos, csak enyhén növeli a relapszus kockázatát. A kezelés mellékhatásai: folyadéktúlterhelés, thrombosis a kanül beszúrási helyén.14 A plazmaferezist 10 napon keresztül, másnaponta alkalmazzuk. Egy alkalommal 200–250 ml plazma/testsúly kg cseréje történik. Az immunadszorpció egy alternatívája a plazmaferezisnek GBS-ben; és egy klinikai vizsgálat eredményei szerint a két kezelés nem különbözik a kimenetel tekintetében. A szelektív immunadszorpció nem volt kevésbé hatékony, mint az IVIG kezelés egy kritikus állapotú GBS betegek bevonásával végzett vizsgálatban.2,13
• Intravénás immuglobulin GBS kezelésében. A GBS patomechanizmusa összetett, celluláris és humorális folyamatok vezetnek az idegek károsodásához, amint ezt az előző fejezetekben részleteztük. Az IVIG hatásmechanizmusa GBS-ben bonyolult, nem teljesen tisztázott és csak részben tulajdonítható a patogén ellenanyag dózisfüggő neutralizálásának anti-idiotípus ellenanyagok révén. Ennek következtében nem jön létre a komplementaktiváció és a komplement mediált citotoxicitás. Emellett az IVIG meggátolja a patogén ellenanyag kötődését a célantigénhez, komplementgátló hatást fejt ki, módosítja az Fc receptorok expresszióját, telíti az IVIG turnoverében szereplő neonatális Fc receptorokat és módosítja a T-sejt-választ; növeli a regulátoros és szuppresszor T-sejtek számát és csökkenti a T-helper sejt szubpopulációt, valamint az effektor molekulák termelését, továbbá semlegesíti a gyulladáskeltő citokineket és gátolja a B-sejteket.17
Az IVIG hatékonyságát számos klinikai vizsgálat igazolta GBS-ben.13,17 A klinikai vizsgálatok adatai szerint a legjobb eredményt a tünetek kezdetét követően két héten belül elkezdve érjük el. Az IVIG dózisa 0,4 g/ttkg öt napig alkalmazva. Egy retrospektív vizsgálat eredményei alapján a valós testsúly helyett az ideális testsúly vagy a korrigált testsúly alkalmazásával 20%-kal csökkenthető a kezelés költsége. Az ideális testsúly férfiaknál 50 kg, nőknél 45,5 kg, amihez minden 152 cm feletti 2,5 cm magasságra 2,3 kg-t adunk hozzá. A korrigált (adjusted) testsúly a túlsúlyos betegeknél használandó, akik 20%-kal meghaladják az ideális testsúlyt, a kiszámolás képlete a következő: korrigált súly = ideális súly – 0,4 ×(tényleges súly – ideális súly).18
Az IVIG mellékhatásai között megkülönböztetünk azonnali mellékhatásokat, mint a fejfájás, az allergia, vagy később megjelenőket, mint az aszeptikus meningitis, a trombotikus események, a posterior reverzibilis encephalopathia szindróma vagy a veseelégtelenség.17
• Az IVIG és a plazmaferezis összehasonlítása és kombinált kezelés. GBS-betegek részvételével végzett összehasonlító randomizált vizsgálatokban az IVIG és a plazmaferezis hatékonysága nem különbözött, így a mindennapi gyakorlatban a választást sok esetben a beteg társbetegségei vagy az adott kezelés elérhetősége határozza meg. Klinikai vizsgálatok során több esetben került sor a plazmaferezis kezelés felfüggesztésére, IVIG-gel összehasonlítva. Az IVIG kezelés némileg kevesebb mellékhatással jár, és hemodinamikailag instabil betegeknél ez a választandó kezelés.13,17
Amennyiben a beteg nem reagál az elsőként választott kezelésre, annak folytatása vagy ismétlése próbálható, így 2 g/ ttkg összdózis IVIG után megismételhető a kezelés, melyet egy közelmúltban lezárult klinikai vizsgálatban értékeltek, illetve öt alkalom plazmaferezis hatástalansága esetén még néhány alkalommal megismételhető, bár ezzel kapcsolatban nem áll rendelkezésre megfelelő evidencia. A két kezelés ötvözése nem javította a kimenetelt és nem rövidítette a betegség tartamát. A mindennapi gyakorlatban a klinikus szembesülhet az egyik vagy másik első választandó kezelés sikertelenségével, mely esetben egy súlyos beteg ellátása során az evidenciák hiányában is megpróbáljuk a másik első választandó kezelést alkalmazni. Ilyenkor érdemesebb plazmaferezissel kezdeni a kezelést, és amennyiben a beteg állapota nem javul, IVIG-gel folytatni, hiszen elméletileg a plazmaferezis eltávolítja a pár nappal korában adott IVIG-et.2 IVIG kezelés ismétlésével kapcsolatban klinikai vizsgálat zajlik.
A betegek 10%-ánál észlelhető kezeléssel összefüggő fluktuáció (treatment related fluctuation), mely esetben az immunterápia alkalmazása során átmeneti javulást követően, a betegség lefolyásának első két hónapján belül a beteg állapota rosszabbodik. Feltehetően ilyenkor hatásos a kezelés, de az immunbetegség még aktív fázisában van, ami magyarázatot adhat a súlyosbodásra. Ezeknél a betegeknél ajánlott az első kezelés megismétlése, bár az ezzel kapcsolatos evidencia nem áll rendelkezésre.2 Két hónap után bekövetkező progresszió esetén inkább akut kezdetű CIDP a valószínű diagnózis.
• Egyéb immunterápiák. Az intravénás methylprednisolon kezelés monoterápiában alkalmazva hatástalan, ezért nem javasolt, IVIG-gel kombinálva gyorsíthatja a javulást, de nem javítja a hosszú távú kimenetelt. Az orális készítmények ezzel szemben késleltetik a javulást. Összességében a kortikoszteroid terápia nem javasolt GBS kezelésére. Az immunmoduláló kezelések közül a komplement inhibitor eculizumabbal történtek vizsgálatok. Egy japán vizsgálatban, noha 24 hónapnál az eculizumab jelentős funkcionális javulást eredményezett GBS-betegekben, így a betegek több mint 90%-a vált önállóan járóképessé és 74%-a volt képes futni (szemben a 71,9%-os és 18%-os értékekkel a placebocsoportban), a vizsgálat összességében nem érte el a kitűzött végpontjait és további vizsgálatokat javasolnak.16
• A GBS-variánsok kezelése. A Miller–Fisher-szindróma jó spontán gyógyulási hajlamot mutat, nem igényel minden esetben immunterápiát, de lényeges a betegek monitorozása a neurológiai tünetek és a légzés tekintetében. Ezzel szemben a Bickerstaff-féle agytörzsi encephalitis súlyos kórforma, kezelése plazmaferezissel vagy IVIG-gel ajánlott, noha ezzel kapcsolatban kevesebb evidencia áll rendelkezésre. Terhes betegeknél, továbbá gyermekeknél úgy az IVIG, mint a plazmaferezis alkalmazható.
A szövődmények megelőzése
A betegség szövődményei jelentős tényezői a morbiditásnak és mortalitásnak GBS eseteiben. A társuló vegetatív diszfunkció miatt a vitális paraméterek monitorozása lényeges a GBS-ben szenvedő betegeknél a szövődmények megelőzése, felismerése és gyors kezelése céljából.15 A magas vérnyomás kezelésére rövid hatású vérnyomáscsökkentő szerek ajánlottak, mint béta-blokkolók vagy nitroprusszid. Hypotensio esetén parenterális folyadékbevitel, bradycardia esetén atropin, ingerületvezetési zavar esetén ideiglenes pacemaker alkalmazása válhat szükségessé. Fontos a beteg megfelelő táplálása, szükség esetén nasogastricus szondán vagy parenteralisan.
Egyaránt fontos szempont a mozgáskorlátozottságból adódó szövődmények (mélyvénás thrombosis, tüdő-embolia, decubitusok) kialakulásának megelőzése, továbbá a fertőzések korai felismerése. A facialis paresises betegeknél figyelmet kell fordítani a cornea védelmére, a cornea-sérülések és -fertőzés kialakulásának megelőzése céljából. A mélyvénás thrombosis megelőzésére kis molekulatömegű heparinok mellett a kompressziós harisnya alkalmazása javasolt. Figyelmet kell fordítani a neurogén hólyag, a székrekedés vagy a hasmenés kezelésére, a fájdalom és a szorongás enyhítésére. A korai rehabilitációhoz tartozik a beteg megfelelő pozicionálása, a passzív és az aktív gyógytorna, amelyek az izomerő javítása mellett segítenek a kontraktúrák és a különböző szövődmények (pl. mélyvénás thrombosis) megelőzésében. A korai rehabilitáció részét képezi a beszédterápia és a dysphagia kezelése, utóbbi a nyelészavarból adódó szövődmények (pl. aspiráció) megelőzését célozza. A betegek állapota hosszú távon, még két év után is javulhat, ezért javasolt hosszú távon a rendszeres gyógytorna folytatása.2,13
A fájdalom kezelése
Számos beteg szenved fájdalomtól, ami lehet a mozgáskorlátozottságból adódó ízületi fájdalom vagy a betegség patomechanizmusával magyarázható neuropathiás jellegű fájdalom. A fájdalom kezelésében a szokásos analgetikumok és nem szteroid gyulladáscsökkentő szerek mellett szerepet kapnak az antiepileptikumok, mint a carbamazepin, a gabapentin és a triciklikus antidepresszánsok (pl. amitryptilin). Az opiátok tartós használata kerülendő az ileus eleve fennálló kockázata miatt. A TENS kezelés csökkenti az izomfájdalmakat. A pszichés támogatás is lényeges a fájdalom és mozgáskorlátozottság okozta szenvedés csökkentésére. A betegség jelentős maradványtünete a fáradékonyság, amely a beteg életminőségére és pszichoszociális teljesítményére egyaránt hatással van, utóbbira kifejezettebben, mint a szomatikus maradványtünetek. A gyógytorna, az alvás minőségének javítása, a fájdalom csökkentése és szükség esetén pszichés támogatás és antidepresszáns kezelés beállítása csökkenthetik a fáradékonyságot.13
PROGNÓZIS
Hat hónap alatt a betegek 80%-a visszanyeri a járóképességét. Ennek a valószínűségét a módosított Erasmus GBS kimeneteli skálán (mEGOS) mérjük fel. Még a lélegeztetést igénylő és a tetraplegiás betegek is jelentősen javulnak az első évben. Halálos kimenetel az esetek 3–10%-ában következik be, főként idős betegeknél vagy olyan esetekben, amikor a tünetek eleve súlyosak voltak. Oka a betegség szövődményeiben keresendő.
Az esetek 2–5%-ában ismétlődhet a betegség, míg 5%-ban a betegség hullámzó lefolyása vagy tartós, nyolc hetet meghaladó progressziója alapján a diagnózis akut kezdetű CIDP-re módosul. Tartós problémát okozhatnak a fennmaradó izomgyengeség és mozgáskorlátozottság mellett a betegek 60–80%-ánál a fáradékonyság, 30–40%-ánál a neuropathiás fájdalom és a depresszió. A betegek ellátása a gyógyulás időszakában is csapatmunka, melyben a neurológus mellett rehabilitációs szakorvos, fizioterapeuta, ergoterapeuta, szükség szerint pszichológus, pszichiáter vesznek részt.
Nyilatkozat. A szerzők a cikk megírása, illetve a kutatómunka során anyagi támogatásban nem részesültek. A szerzőknek a cikk témájával kapcsolatos érdekeltsége nincs. A dolgozat nem sérti a Helsinki Deklaráció előírásait.
Levelezési cím: This e-mail address is being protected from spambots. You need JavaScript enabled to view it.
A szerzők munkahelye:
Dr. Dézsi Lívia: egyetemi tanársegéd, neurológus,
Dr. Babarczy Kristóf: klinikai szakorvos, neurológus,
Dr. Csáti Anett: PhD, klinikai szakorvos, neurológus,
Dr. Klivényi Péter: tanszékvezető egyetemi tanár, az MTA doktora, Szegedi Tudományegyetem, Szent-Györgyi Albert Klinikai Központ, Neurológiai Klinika
Irodalom:
1. Goodfellow JA, Willison HJ. Guillain-Barre syndrome: a century of progress. Nat Rev Neurol 2016;12:723–731
2. Leonhard SE, Mandarakas MR, Gondim FAA, Bateman K, Ferreira MLB, Cornblath DR, et al. Diagnosis and management of Guillain-Barre syndrome in ten steps. Nat Rev Neurol 2019;15:671–683
3. Malek E, Salameh J. Guillain-Barre Syndrome. Semin Neurol 2019;39:589–595
4. Koike H, Chiba A, Katsuno M. Emerging Infection, Vaccination, and Guillain-Barre Syndrome: A Review. Neurol Ther 2021;10:523–537
5. Wijdicks EF, Klein CJ. Guillain-Barre Syndrome. Mayo Clin Proc 2017;92:467–479
6. Kaida K. Guillain-Barre Syndrome. Adv Exp Med Biol 2019;1190:323–331
7. Fokke C, van den Berg B, Drenthen J, Walgaard C, van Doorn PA, Jacobs BC. Diagnosis of Guillain-Barre syndrome and validation of Brighton criteria. Brain 2014;137:33–43
8. van den Berg B, Walgaard C, Drenthen J, Fokke C, Jacobs BC, van Doorn PA. Guillain-Barre syndrome: pathogenesis, diagnosis, treatment and prognosis. Nat Rev Neurol 2014;10:469–482
9. Sejvar JJ, Kohl KS, Gidudu J, Amato A, Bakshi N, Baxter R, et al. Guillain-Barre syndrome and Fisher syndrome: case definitions and guidelines for collection, analysis, and presentation of immunization safety data. Vaccine 2011;29:599–612
10. Yoshikawa K, Kuwahara M, Morikawa M, Fukumoto Y, Yamana M, Yamagishi Y, et al. Varied antibody reactivities and clinical relevance in anti-GQ1b antibody-related diseases. Neurol Neuroimmunol Neuroinflamm 2018;5:e501
11. Uncini A, Ippoliti L, Shahrizaila N, Sekiguchi Y, Kuwabara S. Optimizing the electrodiagnostic accuracy in Guillain-Barre syndrome subtypes: Criteria sets and sparse linear discriminant analysis. Clin Neurophysiol 2017;128:1176–1183
12. Willison HJ, Jacobs BC, van Doorn PA. Guillain-Barre syndrome. Lancet 2016;388:717–727
13. Andary MT, Oleszek JL, Maurelus K, White-McCrimmon RY. Guillain-Barre Syndrome2021. Available from: https:// emedicine.medscape.com/article/315632-overview
14. Chevret S, Hughes RA, Annane D. Plasma exchange for Guillain-Barre syndrome. Cochrane Database Syst Rev 2017;2:CD001798
15. Chakraborty T, Kramer CL, Wijdicks EFM, Rabinstein AA. Dysautonomia in Guillain-Barre Syndrome: Prevalence, Clinical Spectrum, and Outcomes. Neurocrit Care 2020;32:113–120
16. Doets AY, Hughes RA, Brassington R, Hadden RD, Pritchard J. Pharmacological treatment other than corticosteroids, intravenous immunoglobulin and plasma exchange for Guillain-Barre syndrome. Cochrane Database Syst Rev 2020;1:CD008630
17. Dezsi L, Horvath Z, Vecsei L. Intravenous immunoglobulin: pharmacological properties and use in polyneuropathies. Expert Opin Drug Metab Toxicol 2016;12:1343–1358
18. Nguyen TP, Taylor RS. Guillain Barre Syndrome. StatPearls. Treasure Island (FL)2021











