A PRIME program első statisztikai adatai
Az EMA PRIME programja a kielégítetlen egészségügyi szükségletek ellátására fejlesztett gyógyszerek gyorsabb piacra kerülését segíti.
Az Európai Gyógyszerügynökség (EMA) március 7-én indított PRIME (PRIority MEdicines) programja olyan gyógyszerek gyorsabb elérhetőségét teszi lehetővé, amelyek esetében főbb terápiás előny várható a már létező kezelésekhez képest, vagy olyan betegek számára lehetnek hasznosak, akiknél nem áll rendelkezésre kezelési lehetőség. A program nem pusztán az engedélyezést gyorsítja meg, hanem proaktívan nyújt támogatást: már a vizsgálatok megtervezése során tanácsokkal szolgál a gyógyszer előnyeire és kockázataira vonatkozó adatok begyűjtéséhez. Már a kísérletek és vizsgálatok megtervezése és beállítása során segíti, hogy jó minőségű adatok szülessenek, amelyek később megkönnyíthetik, meggyorsíthatják a forgalomba hozatali engedély értékelési eljárását, illetve lehetővé teszik a korlátozott erőforrások lehető legjobb kihasználását. Nagy gyógyszercégek számára is hasznos lehet, ám a program célcsoportja elsősorban a KKV (kis- és középvállalatok) és a tudományos (egyetemi, intézeti) szektor. A mikro-, kis- és középvállalatok (SME-k), valamint az akadémiai, felsőoktatási szektor szereplői ugyanis már figyelemre méltó nem-klinikai adatok és a kezdeti klinikai vizsgálatok tolerabilitási adatai alapján is pályázhatnak a programba. Ezen felül az SME-k és a tudományos intézmények kérvényezhetik a tudományos tanácsadási díjak alóli mentességet, valamint mivel jellemzően ezek a szereplők nem mozognak otthonosan az engedélyeztetési eljárások dzsungelében, különösen hasznos lehet számukra a PRIME-tól érkező iránymutatás.
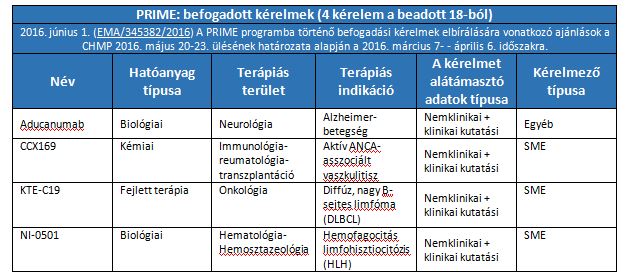
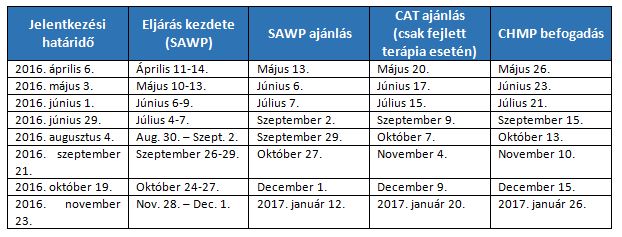
Az Ügynökség most hozta nyilvánosságra első statisztikáit, melyek az elfogadott, azaz a programba felvett, és az elutasított gyógyszerek arányait tartalmazzák. Az első szakaszban, azaz április 6-ig a programba 18 jelentkezés érkezett, ezeket az EMA tudományos tanácsadói munkacsoportja (EMA’s Scientific Advice Working Party, SAWP), a fejlett terápiákkal foglalkozó bizottság (Committee for Advanced Therapies, CAT) és az emberi felhasználásra szánt gyógyszerek bizottsága (Committee for Medicinal Products for Human Use, CHMP) értékelte alkalmasságuk alapján. A bizottságok a jelentkezési határidő lejárta után nagyjából egy hetes időközzel vizsgálják az alkalmasságot az alábbi menetrend szerint:
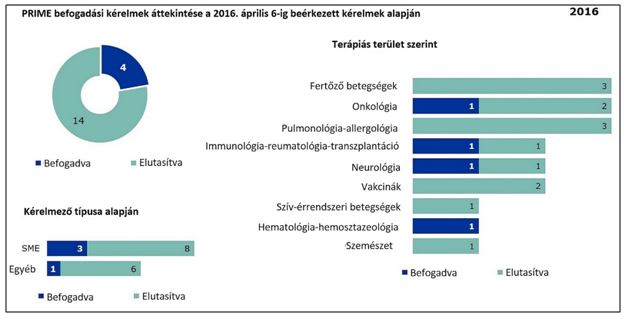
A legelső szakaszban a 18 jelentkezőből 4 kísérleti hatóanyagot fogadtak be a programba. Az EMA nyilvánosságra fogja hozni az egyes szakaszokban befogadott és elutasított gyógyszerek/hatóanyagok összesített statisztikáit a jelentkezők típusa, a terápiás terület és a jelentkezést alátámasztó adatok típusa alapján. A jövőben az Ügynökség havonta közli majd a PRIME statisztikákat, mindig a CHMP plenáris ülését követő szerdán, és ez a CHMP highlights című kiadványban is megjelenik majd.
Az első szakaszra (2016. március 7. – április 6.) vonatkozó eredmények: