Újdonságok a pulmonális artériás hipertónia kezelésében
A pulmonális artériás hipertónia (PAH) mai kezelése más-más támadáspontú készítményekkel nagy előrelépés a 10 évvel ezelőtti lehetőségekhez képest. Metaanalízis igazolja a szerek túlélést javító hatását. A PAH továbbra is súlyos, progresszív kórkép alacsony túléléssel, de a három alapvető gyógyszerosztály mindegyike tartogat új szereket a közeljövőre. A számos új készítmény mutatja, hogy jelentős kutatások zajlanak a pulmonális hipertónia területén, s hogy ez a kutatómunka eddig feltáratlan tudományos információkkal és a betegek jobb kezelésével kecsegtet.
 Dr. Karlócai Kristóf
Dr. Karlócai Kristóf
Pulmonális hipertóniáról (PH) akkor beszélhetünk, ha a tüdőartériákban a jobbszív-katéterezéssel mért átlagnyomás 25 Hgmm fölé emelkedik. Ilyen értékek mai ismereteink szerint terhelés hatására egészségeseknél is előfordulhatnak, de legtöbbször kóros állapotot jeleznek: a tüdőerek falának megvastagodása vagy a fokozott értónus állhat a hátterükben.
Az egészségesek és a sportolók kisvérköri keringését számos tanulmány vizsgálta, és jelenleg is zajlik a normál értékek keresése. Nincs ma egységes kép a terhelésre adott fiziológiás válasz mértékéről, de a nyugalmi körülmények közötti nyomásemelkedést jól fel tudjuk használni a diagnosztikában.
Amikor a tüdőartériák hipertóniája a tüdő vénás oldalán kialakult nyomásemelkedés kompenzálása, a szükséges transzpulmonális gradiens fenntartása érdekében jön létre, a betegséget posztkapilláris PH-nak nevezzük. Ennek mechanizmusát a terápiás következtetések miatt is el kell különíteni a csak artériás oldalon észlelhető artériabetegségtől. Jobbszív-katéterezéssel meghatározhatjuk az ún. „éknyomást” (wedge), amely a tüdő vénás oldalának nyomását mutatja. A PH 15 Hgmm-es érték fölött posztkapilláris, 12 Hgmm alatt prekapilláris, a kettő közötti átmeneti zónával. A posztkapilláris PH hátterében leggyakrabban szívelégtelenség, esetleg a mitrális billentyű szűkülete áll.
A prekapilláris PH hátterében hipoxiás tüdőbetegségek (COPD, intersticiális betegségek, fibrózis), krónikus tüdőembóliás PH és ritkább állapotok állnak, de lehet önálló tüdőartériás betegség is, amit pulmonális artériás hipertóniának (PAH) hívunk. A PAH előfordulhat családi halmozódásban, társulhat bizonyos fogyasztószerek szedéséhez, kötőszöveti betegséghez, HIV-fertőzéshez, krónikus májbetegség miatti portális hipertóniához, veleszületett szívbetegséghez, skisztoszomiázishoz, krónikus hemolitikus anémiához, illetve lehet újszülöttkori eredetű. A PAH hátterében jelentős érelváltozások, a közepes méretű artériák falának megvastagodása állnak, és a megvastagodás mindhárom érfalrétegre kiterjed.
A pontos diagnózis sokféle vizsgálatot igényel, hogy a fenti csoportokba a beteget be tudjuk sorolni. Ezeket a vizsgálatokat PAH-centrumokban lehet elvégezni, mert értékelésükhöz a ritka betegségben való jártasság szükséges. Különösen sok buktatója lehet az invazív nyomásmérésnek. Ugyancsak a centrumok tudnak optimális terápiát javasolni a betegnek, közéjük tartoznak a nagy hatású, kb. egy évtizede rendelkezésre álló orális és a harminc éve alkalmazott parenterális speciális vazodilatátorok.
A specifikus pulmonális vazodilatátorok aránylag friss, a kezelésben jelentős hatású szerek. A szájon át szedhető készítmények száma ez idő alatt növekedett, a terápiás választék szélesedésével egyre több betegnek jelenthetnek kevesebb panasszal, nagyobb terhelhetőséggel, ritkább kórházi felvétellel, jobb prognózissal járó életet. Meg kell azonban keresni a pulmonális hipertóniások közül azokat, akiknél az artériás komponens a döntő (PAH), akiknél a gyógyszeres vazodilatáció sem keringésromlást nem hoz létre, sem a hipoxiát nem súlyosbítja, akiknél tehát ezeket a készítményeket jó eredménnyel alkalmazhatjuk.
Jelenlegi és új kezelések
A véletlen besorolásos vizsgálatok leggyakoribb primer végpontja a funkcionális állapot, illetve a klinikai romlás ideje, és csak újabban, hosszabb távú vizsgálatokban használják a túlélést. Ennek elsőrendű oka a betegek alacsony száma: nagy túlélésvizsgálatokat nehéz megszervezni. A jelenlegi kezelések eredményességét legjobban egy metaanalízis szemlélteti. Ebben 23 randomizált vizsgálat 3140 betegének átlagosan 14,3 hétig tartó kezelése a kontroll- (placebo-) csoport 3,8%-os mortalitásához képest 43%-os csökkenést igazolt (relatív kockázat: 0,57, p=0,023) (1) (1. ábra).
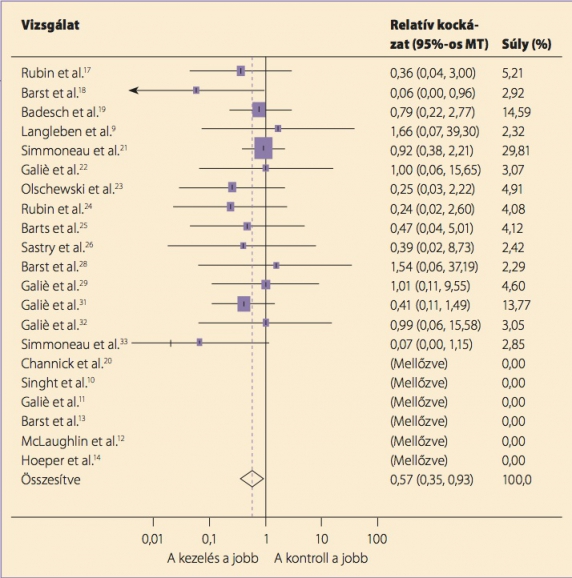
1. ábra. A 2009-es metaanalízis csaknem mindegyik vizsgálatában a kezelt betegek jártak jól (az irodalmi hivatkozások az eredeti cikkben találhatók meg)
Ezen adatok birtokában adjuk ma a betegeknek a bevezetett pulmonális vazodilatátor szereket. A terápiás sikerek ellenére azonban a PAH ma is progresszív, súlyos betegség. (2) A betegek túlélése nem éri el az NIH-konferencia alapján becsült értékeket (2. ábra).
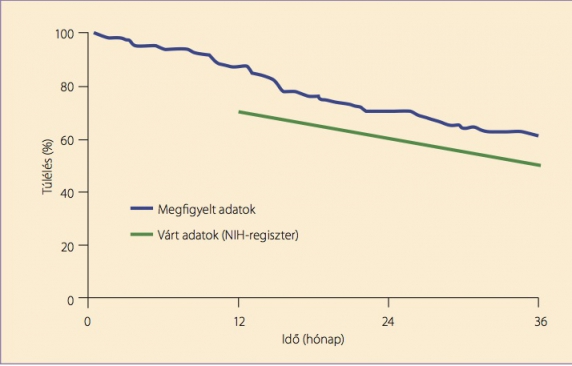
2. ábra. A modern terápiák korában is elmarad a betegek túlélése az NIH-regiszter alapján becsült túléléstől
A pulmonális hipertónia a gyógyszerkutatás egyik forrongó területe, ahol évről évre számos új molekula vizsgálata zajlik, nemritkán kudarccal, de szerencsére néhány esetben egészen a klinikai bevezetésig tartó sikerrel. Így nemcsak a mai, hanem a jövőbeli betegeket is reménnyel töltheti el a nagy kutatási aktivitás.
A PAH gyógyszereinek hatásmechanizmusa
A PAH nem homogén csoport, de a patogenezisben sok hasonló vonást fedezhetünk fel az egyes alcsoportok között. A pulmonális erek vazokonstrikciója és átépülése (remodelling) genetikai okok, gyulladás és a Ca-jelátvitel változása miatt alakul ki. Felbomlik az egyensúly a vazokonstriktív és a vazorelaxációs tényezők között.
A mai klinikai gyakorlatban alkalmazott szerek hatásmechanizmusuk szerint három fő csoportba sorolhatók. A nitrogén-monoxid (NO) hatástani csoportba tartoznak a foszfodiészteráz-5-gátlók (PDE5I), melyek az NO vazodilatációs hatását hosszabbítják meg a cGMP lebomlásának gátlásán keresztül. Az endotelinreceptor-gátlók (ERA) a nagy vazokonstriktor aktivitású endotelin hatását függesztik fel. A prosztaciklin úton ható szerek közé soroljuk a prosztanoid készítményeket, tehát az endoteliális sejtek által termelt hatékony vazodilatátorokat és az IP receptor agonistáit.
Mindhárom mechanizmus készítményeit felhasználjuk a mai klinikai gyakorlatban. A gyógyszerek alkalmazására négyévente rendeznek WHO-konferenciát, ahol megújítják az ajánlásokat. A legutóbbi konferencia Nizzában volt 2013-ban. Az elfogadott kezelési algoritmus továbbra is elsősorban a funkcionális állapot függvényében kínál különböző terápiás erősségű gyógyszereket. (3)
A három fő terápiás hatásból a PD5I és az ERA csoportban vannak új készítmények, amelyeket a legfrissebb terápiás algoritmus már tartalmaz (3. ábra). Közülük néhánynak a piacra kerülése hazánkban is még ebben az évben várható. Az új prosztaciklinkészítmény eredményei még közlés alatt állnak, így ez a szer az ajánlásban nem szerepel. A mai ajánlás már magas szinten tartalmazza a szekvenciális kombinációs kezeléseket, amelyek a betegség progressziója esetén jelentenek igazolt, hatékony megoldást, bár súlyos kiindulási helyzetben az azonnali kombinációs kezelést is egyre több centrumban alkalmazzák.
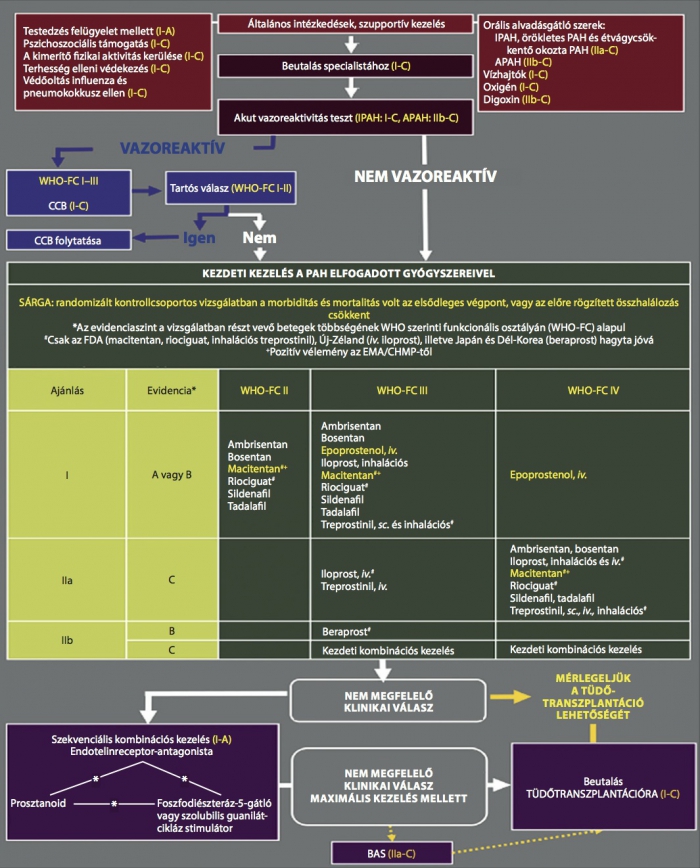
3. ábra. A WHO 2013-as nizzai terápiás ajánlása a pulmonális hipertónia kezelésére
Foszfodiészteráz-5-gátlók
A PDE5I csoportban jelenleg itthon két készítmény, a sildenafil és a tadalafil áll rendelkezésre. A tadalafil nem új szer, de hazai elérhetősége csak a közelmúltban valósult meg, ezért újnak számít az orvosok és a betegek körében is; 2009 óta szerepel a PAH-ajánlásokban. A sildenafiléhoz hasonló a hatásmechanizmusa, de felezési ideje hosszabb, így használatának fő terápiás előnye a napi egyszeri adagolás, ami elegendő a jó klinikai hatáshoz. Ezzel a gyógyszerszedési arány jelentősen javul. A tadalafil terápiás eredményességét részletesen vizsgálták.
A PHIRST vizsgálatba 405 PAH-beteget vontak be, akik 16 hétig placebót, illetve 2,5 mg, 10 mg, 20 mg vagy 40 mg tadalafilt szedtek; 40 mg-os napi adag mellett a primer végpont, a 6 perces járástávolság szignifikáns, 33 m-es növekedését érték el. (4) Emellett a kezelés késleltette és ritkította a klinikai eseményeket, és javította az életminőséget. Fejfájás, izomfájdalom és kipirulás ritkán jelentkezett.
Szintén az NO-csoportba tartozik a riociguat, a szolubilis guanilát-cikláz (sGC) stimulátora, amelynek hatása NO-hiányban is érvényesül.
A PATENT vizsgálatba 443 PAH-beteg került, akik vagy placebót, vagy max. 3×2,5 mg-ig feltitrált riociguatot, vagy max. 3×1,5 mg-ig feltitrált riociguatot kaptak. A vizsgálatban 12 hét alatt a 6 perces járástávolság a 3×2,5 mg-os csoportban szignifikánsan, 30 m-rel nőtt, ami a placebocsoport 6 m-es csökkenését figyelembe véve 36 m-es javulást jelent. Ugyancsak javult a pulmonális vaszkuláris ellenállás (PVR), az NT-proBNP-szint, a funkcionális osztály, kitolódott a klinikai romlás ideje. A leggyakoribb mellékhatás a kb. 4%-ban előforduló szinkópe volt. (5)
A riociguat terápiás felhasználhatóságát jelentősen kiszélesítette a CHEST vizsgálat, mert olyan betegcsoportot célzott meg, amelynek jóváhagyott kezelése addig egyáltalán nem volt: (6) az inoperábilis krónikus tüdőembóliás eredetű pulmonális hipertóniában (CTEPH) szenvedő betegek csoportját. A vizsgálatban 261 CTEPH-beteg 6 perces járástávolsága 46 m-rel javult a placebóhoz képest 16 hét alatt. Ezen túl a PVR is jelentősen javult (–246 dyn×s×cm-5), csökkent az NT-proBNP-szint és a funkcionális osztály. A betegek döntő része 3×2,5 mg-os, illetve 3×2 mg-os adagot tolerált, de volt, aki 3×0,5 mg adag fölé már nem bírt jutni mellékhatások miatt. A jobbkamra-elégtelenség és a szinkópe 2-3% körüli adatai nem különböztek a csoportok között (4. ábra).
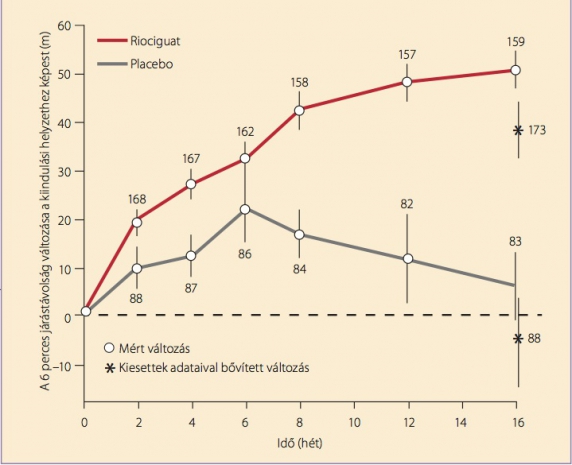
4. ábra. Krónikus tromboembóliás pulmonális hipertóniában riociguat hatására a 6 perces járástávolság 46 m-rel javult a placebóhoz képest 16 hét alatt. (Módosított ITT analízis. A görbéken a mérésben részt vevő betegek száma szerepel. A 16. héten a kiesettek adataival – utolsó érték, illetve a meghaltaknál 0 m – kiegészített értékeket is feltüntettük.)
Endotelinreceptor-gátlók
Két gyógyszerünk tartozik ebbe a csoportba: a bosentan és az ambrisentan. Elsősorban a bosentannal van igen széles körű klinikai tapasztalat. Hatékony szer, de kényelmetlenséget jelent a havi kötelező transzaminázvizsgálat, amit a nem ritka májkárosító hatás indokol. Az új szerek közül a legnagyobb várakozás az új endotelinreceptor-gátló macitentan bevezetését előzte meg. A szer III. fázisú vizsgálatát a PAH-ban szokásosnál lényegesen hosszabb időszakra tervezték, és ezzel kemény végpontot tűzhettek ki célul: a mortalitás és morbiditás (állapotromlás) csökkentését. A macitentan duális endotelinreceptor-antagonista, tehát az ERA-A és ERA-B receptorokra is hat. A szöveti penetrációja a bosentanénál jobb, hosszabb a kötődési ideje. Ezért nem szükséges naponta kétszer szedni, elegendő napi egy adag bevétele, ami jobb gyógyszer-adherenciát biztosít.
A SERAPHIN vizsgálatba 39 ország 151 centrumából sikerült 742 beteget randomizálni. A betegek csaknem egyenlő arányban kaptak placebót, illetve naponta egyszer 3 mg vagy 10 mg macitentant. (7) A kezelési idő az egyes betegekre nézve is átlagosan kb. 100 hét volt. A primer végpontot az alapbetegség romlásáig eltelt idő jelentette. Definíció szerint a betegség romlását jelenthette a halál, a tüdőtranszplantáció, a „bridge”-ként használatos pitvari szeptosztómia, parenterális prosztaciklin bevezetése, vagy a következő három jel együttes észlelése: a 6 perces járástávolság legalább 15%-os csökkenése (ismételt méréssel), a szívelégtelenségi tünetek vízhajtóra nem reagáló súlyosbodása és új PAH-gyógyszer hozzáadása. A másodlagos végpont is több tényezőből állt össze: a 6 perces járástávolságból, a funkcionális állapotból, a PAH miatti kórházi felvételből és a bármely okú halálozásból. A végpontokat független bizottság véleményezte, illetve hagyta jóvá. A primer végpontot a készítmény dózisfüggően befolyásolta: a 3 mg-os csoportban 30%-os, a 10 mg-os csoportban 45%-os mértékben csökkentette (5. ábra). Hasonló irány és mérték volt megfigyelhető a másodlagos végpontban is: napi 3 mg macitentan 33%-os, a napi 10 mg-os adag 50%-os csökkenést hozott (6. ábra). Mellékhatásként leggyakrabban fejfájás, nazofaringitisz vagy anémia lépett fel. Az endotelinreceptor-antagonista csoportra jellemző gyakori transzaminázemelkedés a macitentan hatására egyáltalán nem volt észlelhető. Ezek az adatok reményt adnak arra, hogy klinikai sikereink megszaporodnak majd a macitentan bevezetése után.
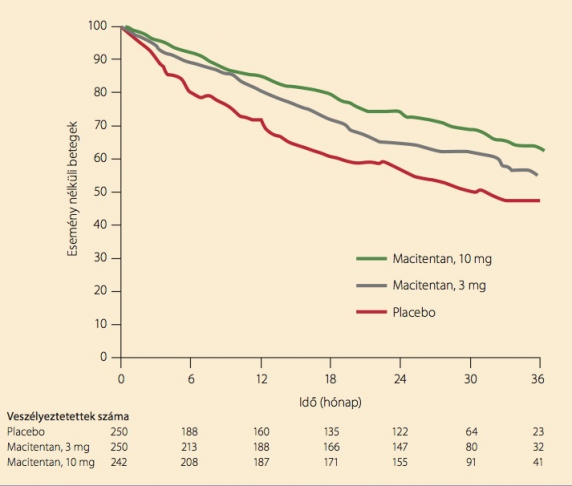
5. ábra. A mortalitási és morbiditási kemény végpontot PAH-ban a macitentan 3 éves megfigyelési idő alatt dózisfüggően, 3 mg mellett 30%-kal, 10 mg mellett 45%-kal csökkentette
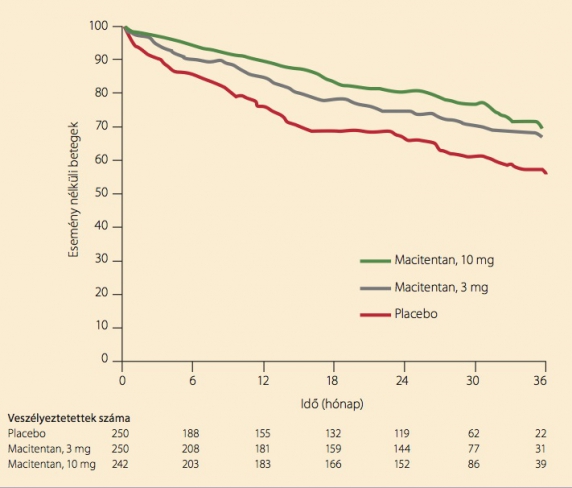
6. ábra. A 6 perces járástávolságból, a funkcionális állapotból, a PAH miatti kórházi felvételből és a bármely okú halálozásból összeállt másodlagos végpontot a macitentan napi 3 mg-ja 33%-kal, napi 10 mg-ja 50%-kal csökkentette
Prosztaciklinek
A harmadik terápiás csoportba, a prosztaciklinek sorába tartozó újdonságok egyrészt az epoprostenol új formulájú változatát jelentik, másrészt egy új molekulával reményt adnak az orálisan is hatásos kezelésre. Az epoprostenol a legrégebbi és a legsúlyosabb, NYHA IV-es funkcionális állapotban mindmáig egyeduralkodó készítmény. Adagolása tartós, folyamatos (24×7) vénás perfúziót igényel. Emellett jelentős kényelmetlenség, hogy a szert már egynapos újratöltési gyakoriság mellett is hűteni kell, mert szobahőmérsékleten bomlékony. Hűtés nélkül legalább napi kétszeri friss adag elkészítése szükséges. Az újfajta epoprostenol (Veletri) hőstabil, és használatával legalább a tasakok folyamatos hűtésének gondjától megszabadulhat a beteg. A tartálytöltéssel elegendő hetente egyszer foglalkozni, ami jelentős könnyebbség az amúgy is nehezített sorsú betegeinknek.
Alternatív prosztaciklin készítmény a hazánkban egyedi méltányossággal elérhető, törzskönyvezett sc. treprostinil. III-as funkcionális osztályban I-es, IV-es osztályben IIaC szintű ajánlás alapján adható. Hatékony szer, de a helyi (hasfali) mellékhatások gyakoriak.
Orális prosztaciklinek már vannak a piacon, de stabil hatékonyságot eddig nem lehetett velük igazolni. A selexipag a már publikált II. fázisú vizsgálata alapján igen hatásos és kedvező a mellékhatásprofilja is, ám a nagy, III. fázisú vizsgálat (GRIPHON) eredményeinek összesítése még zajlik, a közleményt erre az évre várjuk, a készítmény sorsa a részletes feldolgozás adataitól függ.
Összegzés
A pulmonális artériás hipertónia mai kezelése hatásos és más-más támadáspontú készítményekkel nagyon jelentős előrelépés a korábbi – 10 évvel ezelőtti – időszakhoz képest. Metaanalízis igazolja a szerek túlélésre gyakorolt kedvező hatását. Elégedettségre még sincs okunk, a PAH továbbra is súlyos, progresszív kórkép, a túlélés alacsony. A három alapvető gyógyszerosztály mindegyike tartogat új szereket a közeljövőre. A hazánkban frissen piacra került tadalafil napi egyszeri adagolással is hatékony. Még nem érhető el a riociguat – ez a hatékony, jól tolerálható, új utakon ható készítmény azért különösen jelentős, mert egyetlen megoldása lesz az inoperábilis CTEPH kezelésének. A macitentan igen biztató vizsgálatokon van túl, a legújabb vizsgálat primer végpontként mortalitás- és morbiditáscsökkenést igazolt, mellékhatásprofilja igen kedvező, és napi egyszeri adagolással alkalmazható. A hőstabil epoprostenol ma még a hazai betegek számára nem elérhető, az orális selexipag biztató eredményeit pedig még meg kell erősíteniük a frissen lezárt és egyelőre publikálatlan III. fázisú vizsgálat eredményeinek.
Levelezési cím: This e-mail address is being protected from spambots. You need JavaScript enabled to view it.
Irodalom:
1. Galié N, Manes A, et al. A meta-analysis of randomized controlled trials in pulmonary arterial hypertension. Eur Heart J 2009;30:394–403
2. Humbert M, et al. Survival in Patients With Idiopathic, Familial, and Anorexigen-Associated Pulmonary Arterial Hypertension in the Modern Management Era. Circulation 2010;122:156–163
3. Galié N, Corris PA, et al. Updated treatment algorithm of pulmonary arterial hypertension. JACC 2013;62(25 Suppl):D60–D72
4. Galié N, et al. Tadalafil Therapy for Pulmonary Arterial Hypertension. Circulation 2009;119:2894–2903
5. Ghofrani HA, Galié N, et al. Riociguat for the Treatment of Pulmonary Arterial Hypertension. NEJM (2013);369:330–340
6. Ghofrani HA, D’Armini AM, et al. Riociguat for the Treatment of Chronic Thromboembolic Pulmonary Hypertension. NEJM 2013;369:319– 329
7. Pulido T, Adzerikho I, et al. Macitentan and Morbidity and Mortality in Pulmonary Arterial Hypertension. NEJM 2013;369:809–818






