A csontritkulás gyógyszeres kezelése
A terápiában számos készítmény áll rendelkezésre a bizonyítékokon alapuló orvoslás eredményeinek megfelelően – az egyéni kockázati jellemzőktől függő gyógyszerválasztásról és az újabb kutatásokról ad aktuális helyzetképet ez a cikk.
A csontritkulás (oszteoporózis) a vázrendszer generalizált betegsége, ismérve a csonttömeg fogyása és a csontszövet mikroszerkezeti károsodása, ami fokozott törékenységhez vezet. A Németországban 7,8 millió 50 év feletti beteget (BoneEVA vizsgálat) érintő probléma népbetegségnek számít, gyakorisága mindkét nemben növekszik. A csontritkulás prevalenciája a szomszédos német ajkú országokban is emelkedik a korösszetétel változásával, szaporodnak az oszteoporózishoz köthető törések, a kor előrehaladásával a törések gyakorisága is emelkedik. (22) A csontritkulás klinikai jelentősége leginkább a szövődményeiben rejlik, a porotikus combnyak, csuklótáj vagy csigolyatest már csekély erőbehatástól is eltörhet. (31)
Elsődleges megelőzésként fontos a fizikai aktivitás, a megfelelő életmód, a károsító tényezők kerülése. Másodlagos prevenció a kielégítő kalcium- és D-vitamin-ellátás (napi 500–1000 mg kalcium, napi 800–2000 NE D-vitamin). A gyógyszeres terápia szükségessége a törési kockázatból, illetve a már elszenvedett csontritkulásos törésekből következik. A WHO-kritériumok alapján oszteoporózisról akkor beszélünk, ha a T-pontszám nem haladja meg a –2,5-et, és a csontok ásványianyag-tartalma a törés független kockázati tényezője, de egyedül ezekből a kritériumokból az egyéni törési kockázat és a kezelés javallata nem vezethető le. (14,18,33) Sokkal többet mond a teendőkről a denzitometriás mérések és az egyéni környezeti tényezők, életmód, társbetegségek, családi anamnézis együttes figyelembevétele. (21) Az epidemiológiai adatok alapján multifaktoriális kockázatbecslés végezhető pl. a „WHO Fracture Risk Assessment Tool” (FRAX) program használatával. (16)
Gyógyszeres kezelési lehetőségek
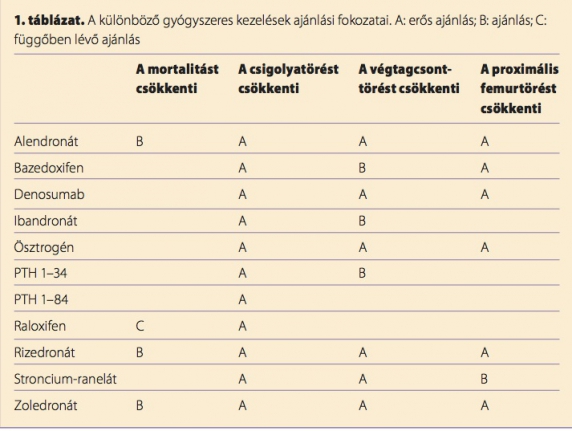
Törés hiányában a terápiás döntést a becsült abszolút töréskockázathoz kell igazítani. Ennek meghatározásában nincs egyetértés az oszteológia képviselői között. Míg Franciaországban, Nagy-Britanniában és Svájcban életkortól függő abszolút töréskockázatot, azaz korral változó intervenciós küszöböt vesznek figyelembe a törésküszöb meghatározásában, (4,17) addig az USA-ban és Németországban fix, kortól független intervenciós küszöböt állítottak fel (lásd a német oszteológiai szervezetek 2009-es irányelveit). (14) Mivel a 2013-ra várt új irányelv még nem jelent meg, erre itt nem hivatkozhatunk. Ma nemcsak a beteg kórtörténetére és kockázati tényezőire alapozott gyógyszeres terápia indikációjának meghatározása lehet egyénre szabott, hanem a különböző hatóanyagcsoportok fejlesztésének köszönhetően a gyógyszerek kiválasztása is. Az 1. táblázat áttekintést ad a különböző lehetőségek ajánlási fokozatairól.
A jelenleg érvényes irányelvek szerint a kezelés indokolt (i) csontritkuláshoz köthető csigolya-, illetve proximális combcsont törése után; (ii) adekvát trauma nélkül létrejött végtagcsonttörés után; és (iii) csökkent csontsűrűség (T-pontszám ≤–2,5), illetve fokozott abszolút töréskockázat (FRAX) esetén.
Hormonterápia
A hormonkezelés a posztmenopauza korai időszakában (első tíz évében) csontritkulásban szenvedő betegeknél jön szóba, átfogó felvilágosítást követően, leginkább akkor, ha a beteg változókori tünetekre panaszkodik. Az emlőkarcinóma, a stroke és a mélyvénás trombózis aggodalmat keltő hormonterápia alatti incidenciája miatt a csontritkulás komoly kockázatának kitett nőket részletes tanácsadásban kell részesíteni, kezelésüket személyre szólóan kell elbírálni. A hormonkezelés 5–10 évig tarthat, de oszteológiai nézőpontból a posztmenopauzális csontritkulás elsődleges prevenciójában nem tekinthető első vonalbeli kezelésnek. Bár egy metaanalízisben megállapítható volt a 60 év alatti nők teljes mortalitásának csökkenése, a 60 évesnél idősebbek korcsoportjában ilyen összefüggést nem tudtak bizonyítani. Egyéb ellenjavallat hiányában a terápia haszna 60 éves kor alatt meghaladhatja a kockázatot. (5)
Szelektív ösztrogénreceptor-modulátorok
A szelektív ösztrogénreceptor-modulátorok (SERM) az ösztrogénreceptorok fiziológiás jelátviteli láncán keresztül szövetspecifikusan ható, nem szteroid természetű anyagok. Agonista hatással vannak a csontanyagcserére, antagonistaként hatnak a méhre és az emlőre.
Az elsőként megismert SERM, a tamoxifen receptorpozitív emlőkarcinómában alkalmazható adjuváns kezelés formájában, és csökkenti a daganat kiújulásának kockázatát. Védő hatással van a posztmenopauzában lévő nők csontanyagcseréjére, csontsűrűségére és lipidmetabolizmusára.
A napi 60 mg raloxifen legalább 4 évig adva alkalmas a posztmenopauzális csontritkulás megelőzésére és kezelésére. Gátolja az oszteoklasztok aktivitását, növeli a csont ásványianyag-sűrűségét és csökkenti a törési kockázatot. Csökkenti az emlőrák veszélyét is, az endometriumra azonban nem fejt ki számottevő hatást. Mellékhatásokra is számítani kell: tromboembóliás eseményekre, némileg gyakoribb hőhullámokra, akárcsak hormonterápia mellett, (20) de a raloxifen a posztmenopauzális csontritkulás hatásos gyógyszerének számít.
További harmadik generációs SERM készítmények vannak klinikai vizsgálati fázisban: a lasofoxifen, a bazedoxifen és az arzoxifen a változókori oszteoporózis terápiájában részlegesen elfogadott gyógyszer, de jelenleg még nem állnak rendelkezésre.
Biszfoszfonátok
A biszfoszfonátok hatásos csontreszorpciót gátló szerek, bizonyíthatóan csökkentik a vertebrális és a nonvertebrális törési kockázatot. (7) A biszfoszfonátok feloszthatók csontfelszívódást gátló hatásuk alapján. Az első generációs etidronátot elégtelen hatása, illetve kifejezett mellékhatásai miatt csak ritkán alkalmazzák.
Második generációs biszfoszfonát a pamidronát. Nem törzskönyvezték a csontritkulás megelőzésére és kezelésére, bár a FOSIT tanulmány eredményei alapján 3 hónapos intravénás alkalmazása a csont ásványianyag-sűrűségét kifejezetten növeli törésen már átesett és még át nem esett betegek esetében egyaránt. Ezenkívül gyorsan csökkenti a csontritkulásos csigolyatörések okozta fájdalmat. Engedélyezték viszont napi 10 mg-os vagy heti 70 mg-os adagban az alendronátot, bázisterápiával kombinálva, mely a FLEX vizsgálat (6) eredményei alapján 5 évnél is tovább bizonyult hatásosnak, ezért nagy töréskockázat esetén ajánlott gyógyszernek minősült. Az alendronát a férfiak csontritkulásának kezelésében is bevált, és csökkenti a csigolyatörés relatív kockázatát szteroid indukálta csontritkulás esetén.
A posztmenopauzális csontritkulás kezelésében engedélyezett harmadik generációs biszfoszfonátok a rizedronát, az ibandronát és a zoledronsav. Használatukat bázisterápiával kombinálva ajánlják. További alkalmazási terület ebben a csoportban is a férfiak csontritkulásának kezelése, valamint a szteroid indukálta oszteoporózis megelőzése és terápiája. Napi 5 mg, illetve heti 35 mg per os rizedronát csökkenti a vertebrális és a nonvertebrális törési kockázatot már 6 havi kezelés után.
Az ibandronát havi egyszeri 150 mg-os dózisban, szájon át adva, illetve negyedévenként adott 3 mg-os intravénás injekcióban egy évi kezelés után bizonyítottan csökkenti a törések kockázatát, hatása 3 évig változatlanul fennmarad. A MOBILE tanulmány alapján az intravénás alkalmazás erőteljesebben javítja a csontsűrűséget és a csontfelszívódási markereket, mint az orális adagolás. Az intravénás ibandronát jobban tolerálható, ezért jobb beteg-együttműködéssel is lehet számolni. Az emlőkarcinómás betegek aromatázgátló adjuváns terápiájában is alternatíva lehet az ibandronát, amely növeli a lumbális csigolyák és a csípő csontsűrűségét. A zoledronát évi 5 mg-os dózisú, rövid intravénás infúzióban alkalmazva csökkentette minden jelentős oszteoporotikus törés kockázatát 3 év alatt, és az első hatóanyag volt, amellyel sikerült csökkenteni a halálozást. A férfiaknál és a posztmenopauzában levő nőknél is jelentősen növeli a teljes csípő csontsűrűségét, és a szteroidszedés okozta csontritkulás esetében – különösen reumás megbetegedésekben – szignifikánsan jobban növelte a lumbális csigolyák és a combnyak csontsűrűségét, mint a rizedronát. (8)
A biszfoszfonátok ismert mellékhatásai az intravénás alkalmazást követő influenzaszerű tünetek, a gasztrointesztinális, izom- és ízületi panaszok. Főleg onkológiai betegeknél a túl gyorsan lefolyt infúzió veseelégtelenséget okozhat, és egyes esetekben állkapocscsont-nekrózisról számoltak be.
Stroncium-ranelát
A stroncium-ranelát a stroncium és a kalcium szoros kémiai rokonsága miatt jelentős affinitást mutat a csontok iránt. Összehasonlítva a csontritkulás kezelésében alkalmazott többi gyógyszerrel, az oszteoblasztokat stimulálja és az oszteoklasztokat is egyértelműen gátolja, így a csontmetabolizmus egyensúlya pozitív. Az esténként bevett, napi 2 mg-os dózisú stroncium-ranelát bázisterápiával együtt alkalmazva, 3 éves kezelés után csökkenti a gerincoszlop és a csípő töréseinek kockázatát, és 8 éven át nyújt védelmet a törésekkel szemben. A posztmenopauzális csontritkulás kezelésének A szintű ajánlásával rendelkezik.
Teriparatid és parathormon 1–84
A teriparatid rekombináns humán parathormonanalóg (PTH 1–34). Napi egyszeri 20 μg-os, szubkután dózisban, legfeljebb 24 hónapig alkalmazva javítja a biomechanikus teherbírást a csontátépítés stimulációján keresztül, nő a trabekuláris állomány és a kortikális állomány sűrűsége is. Ez az első készítmény, amely a korábban elszenvedett, akár súlyos vagy nagyszámú töréstől függetlenül is védelmet nyújt az újabb törésekkel szemben. A teriparatidot engedélyezték a posztmenopauzális csontritkulás kezelésére, de Németországban a kötelező társadalombiztosítás terhére csak második gyógyszerként írható fel manifeszt csontritkulás esetén, abban az esetben, ha a legalább egy éve tartó egyéb antireszorptív kezelés ellenére 24 hónapon belül legalább két új törés következik be, vagy ha a biszfoszfonát, illetve a raloxifen nem tolerálható. A teriparatid csontritkulásban szenvedő férfiaknak is adható fokozott töréskockázat esetén, illetve nagy töréskockázattal járó, szteroid által indukált csontritkulás kezelésére is alkalmazható mind nők, mind férfiak esetében. (20)
Az intakt parathormon (PTH 1–84) napi 100 μg-os szubkután dózisban, legfeljebb 24 hónapon át adva a nagy törési kockázatú nők posztmenopauzális oszteoporózisának engedélyezett gyógyszere. Bizonyíthatóan csökkenti a csigolyatörések gyakoriságát, és egyedüli hatóanyagként serkenti a csont újjáépülését súlyos csontritkulásban. (20) Nemcsak az oszteoblasztok aktivitását fokozza, hanem a csontépítés ellenében ható oszteoklasztokét is. (15,23)
RANK-ligand-gátlás
A tumornekrózis-faktor (TNF) családhoz tartozó RANK-ligand és oszteoprotegerin (OPG) kulcsszerepet játszanak a csontszövet újjáépítésében. Alapvetően befolyásolják az oszteoklasztok differenciálódását és működését. Mind az OPG-t, mind a RANK-ligandot az oszteoblasztok termelik, a sejthez kötött és humorális faktor formájában is létezik. Az OPG szolubilis receptorként képes a RANK-ligandot helyileg gátolni, ezáltal az oszteoklasztok aktivitását csökkenti. A denosumab az IgG2 alosztályba tartozó humán, monoklonális ellenanyag. Célzottan gátolja a RANK-ligand aktivitását, ezzel új megközelítést képvisel az oszteoporózis és más csonttömegvesztéssel járó betegségek terápiájában. A denosumab nagyon nagy affinitást és specificitást mutat a RANK-ligand iránt, nem kötődik olyan célmolekulákhoz, mint a TNFα, a TNFβ, a TRAIL vagy a CD40, amelyek pl. az OPG-vel kölcsönhatásba lépnek. Denosumabhoz kötődő neutralizáló ellenanyagok jelenlétét klinikai tanulmányokban eddig nem lehetett bizonyítani. A FREEDOM tanulmány kimutatta, hogy 3 évig tartó alkalmazás esetén a félévente adott 60 mg-os szubkután injekció szignifikánsan csökkenti a vertebrális, a nonvertebrális törések és a combnyaktörés kockázatát posztmenopauzában. (23,24) A STAND vizsgálat a denosumab erős antireszorptív hatását igazolta, különösen a korábban biszfoszfonáttal kezelt, posztmenopauzális csontritkulásban szenvedő betegek körében. Már egyéves kezelés után kimutatható volt a lumbális csigolyák, a combnyak és a csukló csontsűrűségének növekedése. (24)
Új preklinikai (19,30) és klinikai vizsgálatokban (11,26,32) feltűnt, hogy a denosumab – főleg az alendronáttal összehasonlítva – lényegesen erősebb antireszorptív hatást gyakorol a kortikális csontokra, pl. a femur proximális részére. Ezért előrehaladott korú betegek kezelésekor a denosumab jó választási lehetőség. A biszfoszfonátok a mineralizált csontfelszínen rakódnak le, onnan az érett oszteoklasztok felveszik őket, ezekre a sejtekre közvetlen toxikus hatást gyakorolnak, de közvetett módon, a mevalonsav-anyagcsere befolyásolásán keresztül is hatnak rájuk. A csontfelszínen hosszan nyomon követhetők, az alendronát és a zoledronát kifejezetten hosszú hatástartamú készítmények. Ezzel szemben a denosumab keringő ellenanyagként fejti ki hatását, gátolja az oszteoklasztok proliferációját, differenciálódását és az egész sejtvonal funkcióját, hatását gyorsabban fejti ki: (3) már egy hónapos kezelés után csökken a csont-turnovert jelző CTX paraméter értéke. (24) A fentiek értelmében a denosumab hatástartama is rövidebb, szubkután adagolás mellett felezési ideje mindössze 26 nap. Kiválasztása a retikulohisztiocita rendszeren keresztül történik, függetlenül a vesétől, ezért a denosumab beszűkült veseműködésű betegeknek is adható. (9) A rövidebb hatástartam miatt a biszfoszfonátokkal összehasonlítva a denosumab elhagyását követően gyors rebound reakciót látunk a csontépítésben, és a csontsűrűség hirtelen csökkenni fog. Tartós eredményhez folyamatos kezelésre van szükség. (11,29) A denosumab pozitív tulajdonsága, hogy félévente kell alkalmazni, ez jó beteg-együttműködést jelent. A kezelést nagy törési kockázatú nők, illetve olyan prosztatarákos férfiak számára engedélyezik, akiknél a hormonabláció a csonttömeg csökkenéséhez és a törési kockázat növekedéséhez vezet.
Katepszin K gátlók
A katepszin K inibitorok is befolyásolják az oszteoklasztok közvetítette csontátépülést. (27) A szervetlen csontok demineralizációja a csontfelszín reszorpciós lakúnáiban zajlik a savszekréción keresztül, ezután a szerves mátrix lebomlását olyan proteázok közvetítik, mint a katepszin. A katepszin K-t a papainszerű fehérjebontó enzimek (ciszteinproteázok) családjába sorolják. A specifikus katepszin K inhibitorok gyógyszerfejlesztési vizsgálatai során az odanacatib és az ONO-5334 hatóanyagokat kutatják, ezek ugyanis nagy specificitásuk mellett nem mutatnak jelentős mellékhatást. Az odanacatib heti 3–50 mg-os per os dózisban reverzibilisen gátolja a katepszin K-t, de nem csökkenti az oszteoklasztok számát, s a biszfoszfonátokkal és a denosumabbal összehasonlítva kevésbé kifejezetten gátolja a csontátépülési paramétereket és alig gátolja a csontújdonképződést. (13) Az oszteoklasztok érésében, aktivációjában kulcsszerepet játszó katepszin K enzim a megtartott életképességű oszteoklasztok működését gátolja. Ilyen módon lehetséges a sejtszintű kommunikáció az oszteoklasztok és az oszteoblasztok között, ami megtartott csontújdonképződés mellett gátolja a csontreszorpciót. Ez a szétkapcsoló hatás eltér az összes többi antireszorptív hatóanyag működési mechanizmusától, mert azok mindig sejthalált okoznak. (31)
Friss tanulmányok szerint a csontsűrűség 24 hónapos terápiát követően dózisfüggően nő, a legjobb eredményt a legmagasabb dózissal érték el. Dózisfüggő, jelentős mellékhatást (bőrgyógyászati eltérés, légúti infekciók) nem tudtak bizonyítani. A terápia egy évvel való meghosszabbítása további pozitív hatással volt a csontsűrűségre. A denosumab elhagyásához hasonlóan és a biszfoszfonátokétól eltérően az odanacatib leállítása után újra csökkenni kezd a csonttömeg, mivel a gyógyszer nem tárolódik a csontokban.
Antiszklerosztin ellenanyag
Az oszteociták által elválasztott szklerosztin kulcsszerepet játszik a csontszövet-anyagcsere szabályozásában, kompetitíven gátolja az LRP5/FZD receptorkomplexet, ezáltal szabályozza az oszteoblasztok differenciálódását és aktivitását. Az antiszklerosztin antitest gátolja a szklerosztin funkcióját és javítja az oszteoblasztok aktivitását, így fokozza a csontszövet képződését. Ez tehát olyan csontszövetépítő gyógyszernek tűnik, amely a csontépítésre tisztán pozitív hatással van, a csontvesztést nem stimulálja. A szklerosztin egyike annak a kevés csontszelektív modulátornak, amit csak az oszteociták termelnek. (1,2) Friss tanulmányok igazolják, hogy férfiak és posztmenopauzális csontritkulásban szenvedő nők csontépítést jelző paraméterei már egyszeri antiszklerosztin antitest injekció hatására dózisfüggő növekedést mutatnak, a csontreszorpciót jelző C telopeptid szérumszint csökken, a csontsűrűség nő. (28) Az ezzel kapcsolatos III. fázisú klinikai tanulmány eredményeit érdeklődéssel várjuk.
Nyilatkozat. A szerzők nem jeleztek érdekütközést.
MEDIKAMENTÖSE THERAPIE DER OSTEOPOROSE • VOL 139 / NO 10 / 2014 / DEUTSCHE MEDIZINISCHE WOCHENSCHRIFT
Levelezési cím:
This e-mail address is being protected from spambots. You need JavaScript enabled to view it.
Irodalom:
1. Baron R, Kneissel M. WNT signaling in bone homeostasis and disease. Nature Med 2013;19:179–192
2. Baron R, Saito H, Gori F. Bone cells crosstalk: noncanonical Roring in the Wnt. Cell Metab 2012;15:415–417
3. Baron R, Ferrari S, Russell RG. Denosumab and bisphosphonates. Bone 2011;48:677–692
4. Birkhäuser M, Hadji P, De Geyter C, et al. Osteoporose: Phasengerechte Therapie und Neues aus der Zellbiologie. J Mineralstoffw 2012;15:3–7
5. Birkhäuser M. Selektive Oestrogen- Rezeptormodulatoren (SERMs) zur Prävention und Therapie der postmenopausalen Osteoporose. Ther Umsch 2012;69:163–172
6. Black DM, Schwartz AV, Ensrud KE, et al. Effects of continuing or stopping alendronate after 5 years of treatment: the Fracture Intervention Trial Long-term Extension (FLEX). JAMA 2006;296:2927–2938
7. Black DM, Bauer DC, Schwartz AV, et al. Continuing bisphosphonate treatment for osteoporosis. N Engl J Med 2012;366:2051–2053
8. Black DM, Reid IR, Boonen S, et al. The effect of 3 versus 6 years of zoledronic acid treatment of osteoporosis: a randomized extension to the HORIZON-Pivotal Fracture Trial (PFT). J Bone Miner Res 2012;27:243–254
9. Block GA, Bone HG, Fang L, et al. A single-dose study of denosumab in patients with various degrees of renal impairment. J Bone Miner Res 2012;27:1471–1479
10. Briot K, Cortet B, Thomas T, et al. 2012 update of French guidelines for the pharmacological treatment of postmenopausal osteoporosis. Joint Bone Spine 2012;79:304–313
11. Brown JP, Roux C, Torring O, et al. Discontinuation of denosumab and associated fracture incidence: analysis from the Fracture Reduction Evaluation of Denosumab in Osteoporosis Every 6 Months (FREEDOM) trial. J Bone Miner Res 2013;28:746–752
12. Brown JP, Prince RL, et al. Comparison of the effect of denosumab and alendronate on BMD and biochemical markers of bone turnover in postmenopausal women with low bone mass. J Bone Miner Res 2009;24:153–161
13. Costa AG, Cusano NE, Silva BC, et al. Cathepsin K: its skeletal actions and role as a therapeutic target in osteoporosiS. Nat Rev Rheumatol 2011;7:447–456
14. Dachverband Osteologie e.V. DVO guideline 2009 for prevention, diagnosis and therapy of osteoporosis in adults. Osteologie 2011;20:55–74
15. Hodsman AB, Bauer DC, Dempster DW, et al. Parathyroid hormone and teriparatide for the treatment of osteoporosis. Endocr Rev 2005;26:688–670
16. Kanis JA, Oden A, Johansson H, et al. FRAX and its applications to clinical practice. Bone 2009;44:734–743
17. Kanis JA, McCloskey EV, Johansson H, et al. European guidance for the diagnosis and management of osteoporosis in postmenopausal women. Osteoporos Int 2013;24:23–57
18. Kanis JA, Burlet N, Cooper C, et al. European guidance for the diagnosis and management of osteoporosis in postmenopausal women. Osteoporos Int 2008;19:399–428
19. Kostenuik PJ, Smith SY, Jolette J, et al. Decreased bone remodeling and porosity are associated with improved bone strength in ovariectomized cynomolgus monkeys treated with denosumab, a fully human RANKL antibody. Bone 2011;49:151–161
20. Kraenzlin ME, Meier C. Parathyroid hormone analogues in the treatment of osteoporosis. Nat Rev Endocrinol 2011;7:647–656
21. Kraenzlin ME, Meier C. Schlaglichter 2010: Neue Wege in der Diagnostik und Therapie der Osteoporose. Swiss Med Forum 2011;11:25–28
22. Lippuner K, Johansson H, Kanis JA, et al. Remaining lifetime and absolute 10–year probabilities of osteoporotic fracture in Swiss men and women. Osteoporos Int 2009;20:1131–1140
23. McClung M, Harris ST, Miller PD, et al. Bisphosphonate therapy for osteoporosis: benefits, risks, and drug holiday. Am J Med 2013;126:13–20
24. McClung MR, Lewiecki EM, Geller ML, et al. Effect of denosumab on bone mineral density and biochemical markers of bone turnover. Osteoporos Int 2013;24:227–235
25. McClung MR, San Martin J, Miller PD, et al. Opposite bone remodeling effects of teriparatide and alendronate in increasing bone mass. Arch Intern Med 2005;165:1762–1768
26. McClung MR, Zanchetta JR, Hoiseth A, et al. Denosumab densitometric changes assessed by quantitative computed tomography at the spine and hip in postmenopausal women with osteoporosis. J Clin Densitom 2013;16:250–256
27. Meier C, Kraenzlin M. Kathepsin-K-Inhibitoren in der Osteoprosetherapie. Osteologie 2011;20:211–216
28. Padhi D, Jang G, Stouch B, et al. Single-dose, placebo-controlled, randomized study of AMG 785, a sclerostin monoclonal antibody. J Bone Miner Res 2011;26:19–26
29. Papapoulos S, Chapurlat R, Libanati C, et al. Five years of denosumab exposure in women with postmenopausal osteoporosis. J Bone Miner Res 2012;27:694–701
30. Pierroz DD, Bonnet N, Baldock PA, et al. Are osteoclasts needed for the bone anabolic response to parathyroid hormone? J Biol Chem 2010;285:28164–28173
31 . Rachner TD, Khosla S, Hofbauer LC. Osteoporosis: now and the future. Lancet 2011;377:1276–1287
32. Seeman E, Delmas PD, Hanley DA, et al. Microarchitectural deterioration of cortical and trabecular bone. J Bone Miner Res 2010;25:1886– 1894
33. Schweizerische Vereinigung gegen die Osteoporose (SVGO). Osteoporose. Diagnostik, Prävention, Behandlung. http://www.svgo.ch/ content/documents/SVGO_Empfehlungen2010_ V19April2010.pdf
Kommentár
A csontritkulás gyógyszeres kezelése Dr. Szekeres László
Dr. Szekeres László
Főorvos. Országos Reumatológiai és Fizioterápiás Intézet, Budapest
Az oszteoporózis gyógyszeres kezelésével kapcsolatos gyakorlati információkat tartalmazó közleményt a svájci Fassbender professzor tollából neves német szaklap, a Deutsche Medizinische Wochenschrift közölte ebben az évben. A részletes, gyógyszervizsgálati eredményekkel alátámasztott gyakorlati útmutató részletezi a közeljövő gyógyszeres lehetőségeit is. Nagyon pontosan adja meg a hatóanyagok terápiás helyét és azokat a szakirodalmi adatokat, amelyek segítették a gyógyszerek terápiában betöltött szerepének megítélését.
Az oszteoporózis a csontváz generalizált, progresszív megbetegedése, amelyben a csonttömeg megfogyatkozása, a csontszerkezet (mikroarchitektúra) károsodása, illetve a csontminőség ebből adódó romlása fokozott törékenységhez vezet. Oszteoporózissal összefüggésbe hozható törésnek hívjuk a csontváz bármely részén kis erőbehatásra bekövetkező csonttörést. Típusos lokalizációnak tartható a csigolyatest, a radius disztális (csuklóközeli) vége, a humerus proximális (válltáji) része és a csípőtájék (elsősorban a combnyak). Az oszteoporózis terápiájának célpontja a csontbontás (reszorpció) gátlása és/ vagy a csontépítés (formáció) fokozása. A csontanyagcserét szabályozó egyre több új faktor megismerése elősegíti az új terápiás hatóanyagok kifejlesztését is.
A gyógyszeres kezelés tárgyalása során nem nélkülözhető az a jövőben várható jelentős paradigmaváltás, miszerint az új lehetőségek (pl. szklerosztin elleni antitest, kalcilitikumok, PTHrp-analógok) eredményeként a terápiás algoritmus, a kezdeti terápiás választás eltolódik az ún. anabolikumok irányába, illetve abba az irányba, hogy az így megnyert csontmennyiséget, és különösen a kedvezőbb csontminőséget, antireszorptív kezelésekkel megtartsuk.
A hazai adatok, ismérvek és eredmények
A cikk természetesen a németországi adatok alapján készült, és a referáló nem tehet mást, mint áttekinti a hazai eredményeket. Annál is szívesebben teszem ezt, mert nemzetközileg is igen komoly előrelépések és eredmények jellemzik a magyarországi helyzetet. Magyarországon egyedülálló, hogy 2004 és 2011 között a csontritkulás miatt kezelt betegek körében folyamatosan csökkent a csonttörések száma. Mindez igaz volt a csípőtáji töréseket külön vizsgálva is. Érdekesség, hogy az oszteoporotikus betegek mortalitása szignifikánsan kisebb volt, mint a hasonló korú hazai lakosságé, ami a hatékony oszteoporózis elleni kezelés mellett az oszteoporózissal foglalkozó ellátóhálózat egyébirányú kiemelkedő gondozási tevékenységének is köszönhető. A törésszám csökkenésének következményeképpen évi 3,4 milliárd forintot takarított meg a biztosító, ez nagyjából megegyezik az oszteoporózis elleni gyógyszerekre költött évi 3,5 milliárd forint támogatással, azaz a befektetett anyagiak megtérülnek. A WHO nemzetközileg elfogadott mércéje alapján, életminőséggel korrigált életévekben kifejezett költséghatékonysági adatok azt mutatják, hogy ezeket az eredményeket a hazai körülmények között messzemenően költséghatékonyan tudjuk produkálni. (1) Mindez természetesen alapvetően függ az elérhető (azaz támogatott) gyógyszerrendelési lehetőségektől, a szakellátásban dolgozó egészségügyi szakemberek felkészültségétől. A fenti eredmények így magukért beszélnek.
Hazánkban a finanszírozási (2,3) és a szakmai protokoll (4) igen korszerű és egymáshoz egyre jobban közelítő formája alkalmat ad arra, hogy a szakmai alapokon nyugvó gyógyszeres kezelés elérhető legyen a rászorulók számára. Különösen nagy öröm, hogy a legmodernebb hatóanyagok is a betegek rendelkezésére állhatnak, és reményeink szerint ez lesz a helyzet a befogadás előtt álló még újabb készítményekkel (katepszin-K-gátló – odanacatib – és szklerosztin elleni antitest) is. A jelenleg érvényben lévő protokoll olyan algoritmuson alapszik, amely a per os biszfoszfonátkezelésre épül, de a jól körülhatárolt hatástalanság vagy a gyógyszerrel szembeni intolerancia, mellékhatás lehetővé teszi az azonnali gyógyszerváltást – akár az alkalmazási módjában (intravénás), akár a hatásmechanizmusában eltérő (RANKL ellenes antitest: denosumab; teriparatid, stroncium-ranelát stb.) hatóanyagra való váltást.
Szintén büszkék lehetünk arra, hogy a csontszilárdság megőrzése, illetve javítása tekintetében a kezelés alappillére, a megfelelő fizikai aktivitás, a kalcium és a D-vitamin normális szintjének helyreállítása és folyamatos fenntartása hazánkban is a támogatás feltétele. Megszámlálhatatlan szakirodalmi tény igazolja, hogy ezek nélkül a csontanyagcserét kedvezően befolyásoló készítmények ideális hatáserőssége nem érhető el. A hazai ajánlás szerint a napi kalciumbevitel 1000–1200 mg (lehetőség szerint táplálkozás útján, kalciumdús étrend betartásával), míg a D-vitamin ajánlott napi bevitele 800–2000 NE (ennek biztosítására a magyarországi táplálkozási szokások nem adnak lehetőséget, így leggyakrabban gyógyszeres D-vitamin-pótlásra kényszerülünk). (5)
A FRAX6 jelentheti a közeljövőben a terápiás döntéshozatal egyik fontos lépését. A 10 éves törési kockázat egyszerű kiszámítására alkalmas internetes hozzáférés megerősítheti a terápia indokoltságát, ugyanakkor nem alkalmas sem diagnózis felállítására, sem a betegség vagy a csontritkulásban szenvedő beteg állapotának ellenőrzésére. A diagnózis továbbra is több adat alapján állítható fel.
A jövő feladatai
A jövő egyik nagy kihívása a célzottabb antiporotikus terápia biztosítása, miszerint azok a betegek, akik oszteoporózissal összefüggésbe hozható törést szenvedtek el, a jelenlegi tapasztalatokkal ellentétben ne kerülhessék el az adekvát ellátást és az oszteoporózis korszerű kezelését. A másik – a világban szintén sok helyütt közismert – orvosolandó probléma, hogy a betegek gyógyszerszedéssel kapcsolatos együttműködési készsége igen alacsony, ami önmagában is elegendő lehet a készítmény hatástalanságához és a törési kockázat emelkedéséhez. A komolyabb anyagi terhet nem jelentő compliance-javulással egyenes arányban csökkenthető a törések előfordulása.
Levelezési cím:
This e-mail address is being protected from spambots. You need JavaScript enabled to view it.
Irodalom:
1. Lakatos P, Tóth E, Szekeres L, et al. A csontritkulás kezelésének hatékonysága Magyarországon. LAM KID 2012;2(3):5–12
2. http://site.oep.hu/steam/downloads/ finprot_20131115/hatalyos/0626_osteoporosis_ primer_prevencio_finanszirozasi_protokoll.pdf
3. http://site.oep.hu/steam/downloads/finprot_ 20131115/hatalyos/0626_osteoporosis_szekunder_ prevencio_finanszirozasi_protokoll.pdf
4. A Nemzeti Erőforrás Minisztérium szakmai protokollja a korral járó és a kortikoszteroidok indukálta osteoporosis diagnosztikájáról és terápiájáról. Egészségügyi Közlöny 2011;61(7):1522–1532
5. Takács I, Benkő I, Toldy E, et al. Második magyarországi konszenzus a D-vitamin szerepéről a betegségek megelőzésében és kezelésében. Magyar Orvos 2014;22(Suppl. 1):5–26
6. http://www.shef.ac.uk/FRAX
a szerző cikkei
Dr. Birgit Willmann
a szerző cikkei
Dr. Szekeres László
a szerző cikkei





