Az NSAID-ok adását lehetőleg előzze meg a kondroprotekció
Farmakoökonómiai modell az arthrosis gyógyszeres kezelésének költségcsökkentésére
A szerzők áttekintik az arthrosis hazai költségeit, a korszerű kezelésre vonatkozó nemzetközi ajánlásokat, a nem szteroid gyulladáscsökkentők (NSAID) mellékhatásait, azok kivédésének lehetőségeit. Ismertetik Conrozier 11000 arthrosisos beteg gyógyszeres kezelésének analízisével kapcsolatos felméréseit.
Eszerint a kondroitin-szulfát-kezelésben részesülők jelentős részénél elhagyható az NSAID-kezelés. Tarricone modellt dolgozott ki az NSAID kondroitin-szulfáttal való helyettesítésével elérhető megtakarítás kiszámítására. A szerzők hazai adatok és becslések alapján megállapították, hogy ha csak az NSAID-kezelésben részesülő arthrosisos betegek fele e gyógyszerek helyett évente kétszer 3 hónapig kondroitin-szulfát-kezelést kapna, azzal 3,3 milliárd forintot és számos NSAID okozta halálesetet takaríthatnánk meg. Véleményük szerint a kondroprotektív terápia mellett csak szükség esetén, a lehetô legrövidebb ideig kapjon NSAID-ot az arthrosisos beteg.
Az arthrosis gazdasági és társadalmi terhe
Az arthrosis hatalmas társadalmi és gazdasági teher. (1,2) A betegség jelentősen rontja az életminőséget és gyakran okoz fogyatékosságot (3,4,38) (1. ábra).
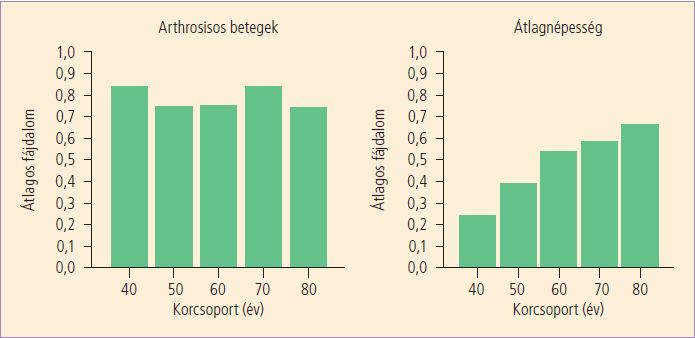
1. ábra. A fájdalom életkorfüggő prevalenciája az átlagnépességben és az arthrosisos betegek között az EuroQoL alapján
Számos tévhittel ellentétben gyakran betegít meg munkaképes korú embereket (2,38) (2. ábra).
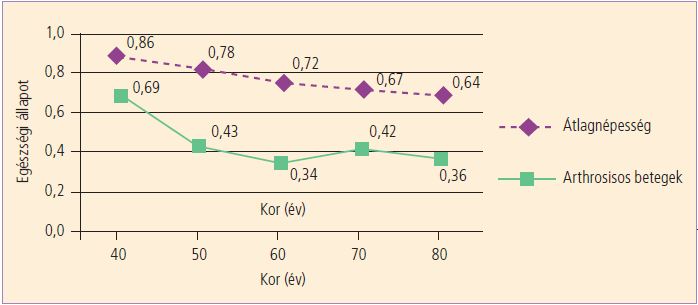
2. ábra. Az átlagnépesség és az arthrosisos betegek EuroQoL-lal mért életminőségének összehasonlítása
Fontos tudnunk, hogy az arthrosis a szív- és érrendszeri betegségek előfordulását és halálozását a duplájára növeli. (5) Az Egyesült Államokban egy ízületi beteg ellátásának egyéves direkt költsége 7600 USA-dollár (1,5 millió forint) volt. (1)
Hazánkban az arthrosis okozta panaszok miatt szakorvoshoz forduló betegek száma 2008-ban 1631200 fő; ebben az évben 26230 beteg került betegállományba arthrosisa miatt, átlagosan 35,6 napra. A betegállományban töltött napok száma összesen 933788 volt. Átlagosan napi 3000 forint táppénzzel számolva ez összesen 2801364000 forintjába került az OEP-nek. (6)
Kórházban aktív osztályon 21487, krónikus osztályon 8411 arthrosisos beteget kezeltek, átlagosan 11,2, illetve 21,3 napig, azaz összesen 240654, illetve 179154 napig. A konzervatív kórházi kezelés költsége összesen 12089114462 forintnak bizonyult. (6) Ha a műtéti kezelések közül csak a csípő és térd endoprotézis műtéteket számítjuk, ezek száma 2006-ban 14451, költsége 6,5 milliárd forint volt. Az OECD adatai szerint hazánkban a 100000 lakosra jutó csípőízületi endoprotézis műtétek száma 96, a térdízületi endoprotézis műtéteké 47, míg az OECD-átlag 147, illetve 106. (7)
Hazánkban a mozgásszervi vezető diagnózissal rokkantosítottak száma évről évre jelentősen csökken, 2008-ban 27043 új rokkant között 309-en szerepelnek arthrosis diagnózissal, akiknek 70000 forintos havi átlaggal számolva évente, összesen 259560000 forint rokkantnyugdíjat fizettek ki. (6)
Az arthrosis kezelése
Az arthrosis kezelését a European League Against Rheumatism (EULAR) megfelelő terápiás ajánlásai alapján végezzük. Ezek, valamint az Osteoarthritis Reseasch Society International (OARSI) és az American College of Rheumatology (ACR) ajánlásai szerint is igen fontos a megfelelő betegfelvilágosítás, a betegoktatás, az aerob terhelés és a gyógytorna. (8–12)
A nem szteroid gyulladáscsökkentők alkalmazása és mellékhatásai
A gyógyszeres kezelésben egyszerű fájdalomcsillapítók, ezek eredménytelensége esetén nem szteroid gyulladáscsökkentők (NSAID), enyhe opioidok, ritkán erős opioidok alkalmazandók. Sajnos az egyszerű fájdalomcsillapítók rendelését nem támogatja az OEP, így a betegeknek hazánkban olcsóbbak az NSAID szerek. Ez utóbbiak a szívet, a gyomrot és az érrendszert károsító mellékhatásaik miatt, főleg 65 éven felüli korban, gyakran ellenjavalltak. (13) Toxicitásukra jellemző, hogy 900 egészséges, önkéntes fiatalon végzett vizsgálat során már egyhetes NSAID- vagy acetil-szalicilsav- (ASA-) szedés után a vizsgálati alanyok 8%-ánál alakult ki fekély. (14) Egy friss irodalmi áttekintés szerint a gyomorperforáció és gyomorvérzés halálozása 1997 óta 11,6%-ról 7,4%-ra csökkent, de a felmérésben szereplő 5526, NSAID-ot vagy ASA-t szedő beteg esetében 14,7%-ról 20,9%-ra nőtt. (15) Ennek oka ismeretlen, de tény, hogy a gyomorvédő ajánlásokat négy közül három beteg tartja be. (13) Amerikai adatok alapján az 1993 és 1997 közötti időszakban minden NSAID-kezelésre költött dollárra 0,66 dollár költségű szövődmény jutott. (16) Az NSAID-ot szedő arthrosisos betegek között 3-4%-ban lép fel jelentős, 1,5%-ban súlyos gasztrointesztinális szövődmény. (17) Singh adatai szerint az USA-ban 8 millió beteg szed NSAID-ot, közülük évente 56000 főt kell kórházba felvenni, és 16500 a halálos kimenetelű gyomor-bél rendszeri halálozások száma. (18)
Prónai (19) az Egyesült Államok adatait interpolálva hazánkban évi 800 halálesettel számol, amiből az arthrosis kezelésének halálozása 400 körül van. Pontos hazai adatok nincsenek.
Az NSAID-szedés fokozott kockázati tényezői: fekély, vérzés az anamnézisben, 60 év feletti kor, kortikoszteroid szedése, ASA szedése 75 mg-os vagy annál nagyobb dózisban. (20) Ezekben az esetekben okvetlenül szükséges a gyomorvédelem.
A H2-receptor-blokkolók csak a duodenum-fekély kialakulását gátolják, a gyomorfekélyét nem. (21) Dupla dózis famotidin a gyomorfekély megelőzésére is hatásos, de a protonpumpagátlók is csak az esetek kétharmadában hatékonyak. (22)
Saját felmérésünk szerint mind a reumatológusok, mind a háziorvosok 67%-ban NSAID-ot alkalmaznak térd-arthrosisos betegeik kezelésére (23) (3. ábra).
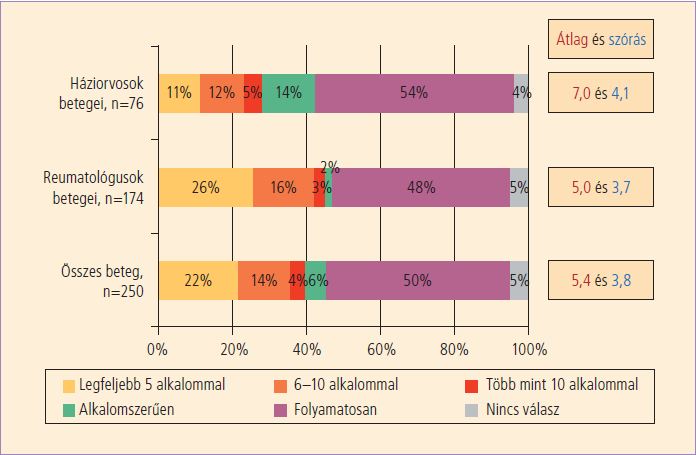
3.ábra. Évente hány alkalommal szed orvos által felírt fájdalomcsillapító gyógyszert a beteg?
A betegek gyakran kétféle NSAID-ot is szednek, mert nem tudják, hogy a vény nélkül kapható fájdalomcsillapítók is nagyrészt ilyen gyógyszert tartalmaznak, s ez ugyan terápiás előnyt nem jelent, de a mellékhatások kockázatát fokozza (4. ábra).
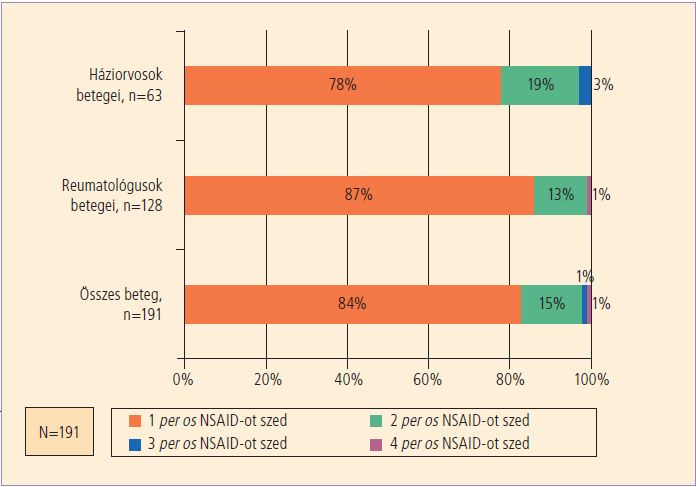
4. ábra. A betegek által szájon át szedett nem szteroid gyulladáscsökkentő gyógyszerek (NSAID) száma az orvosok adatai szerint
E szerek az arthrosis okozta fájdalmat és gyulladást csökkentik, de a betegség progresszióját és a porcvesztést nem gátolják. Tapaszban vagy kenőcsben alkalmazott NSAID gyulladáscsökkentők magas koncentrációban jelennek meg a kezelt térdízület szöveteiben, alacsony plazmakoncentráció mellett, (24,25) épp ezért hatásosak és ritkán okoznak súlyos mellékhatást. (26)
Intraartikuláris kezelés
Arthrosis gyulladásos stádiumában alkalmazhatunk intraartikuláris kortikoszteroid injekciót. (27) Az intraartikulárisan adott hyalouronan gyulladáscsökkentő és fájdalomcsillapító hatása lassabban alakul ki, de tartósabb. (28)
Betegségmodifikáló gyógyszerek
Ma már azonban vannak a birtokunkban a betegség progresszióját, illetve a porcvesztést gátló szerek is. Ezeket SYSADOA-nak (symptome modifying slow acting drugs of osteoarthritis) vagy DMOAD-nak (disease modifying osteoarthritis drugs), vagy egyszerűen kondroprotektív szereknek nevezzük. Ezek közé tartozik a kondroitin-szulfát, melynek alkalmazását a nemzetközi ajánlások egyértelműen javasolják. (11,12) Hosszú távon a placebóhoz képest csökkenti a porcvesztést, (29,30) ugyanakkor néhány heti szedés után jelentkező fájdalomcsillapító és gyulladáscsökkentő hatása is van, (29,31) mely nem túl erős fájdalommal járó esetekben elegendő lehet a fájdalom és a gyulladás csillapításához. Az arthrosis modern kezelésének lépcsőit legjobban az OARSI és az ACR Arthrosis Albizottságának terápiás piramisa (11,12) szemlélteti (5. ábra).
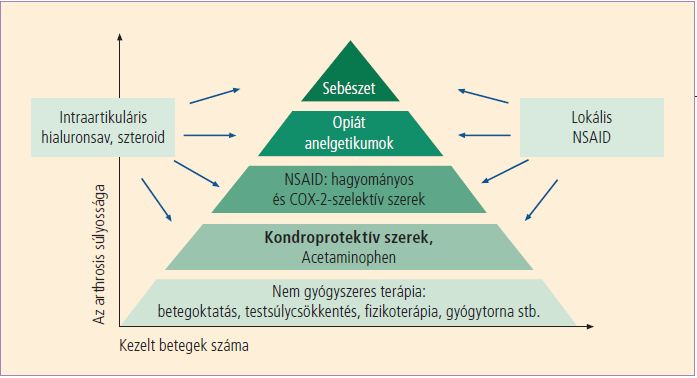
5. ábra. Az arthrosis terápiás piramisa
Az American College of Rheumatology Arthrosis Bizottságának szakmai protokollja12 és Zhang et al., 200811 nyomán, módosítva
A STOPP és a Zürich vizsgálat (29,30) során napi 800 mg kondroitin-szulfát hatását a placebóéval hasonlították össze, 2 évig adva a kezelést. A kondroitin-szulfáttal kezelt csoportokban a térdízületi rés szignifikánsan kevésbé csökkent, mint a placebocsoportokban.
Egy 2011-ben publikált vizsgálatban Wildi és mtsai32 MR-vizsgálattal már 6 hónapos kezelés után is szignifikánsan kisebbnek találták a porcvolumenvesztést napi 800 mg kondroitin-szulfátot szedő betegeknél a kontrollcsoporthoz képest.
Az arthrosis kondroitin-szulfáttal és NSAID-dal való kezelésének költsége
Conrozier (33) két francia adatbázis felhasználásával több háziorvos és 400 szakorvos – köztük 90 reumatológus – összesen 11000 betegén analizálta az NSAID- és a kondroitin-szulfát- felírási arány változását. A betegeket kondroitin-szulfátot szedőkre és kondroitin-szulfátot nem szedőkre választották szét. A két csoport kor, nem, az arthrosis fajtája és súlyossága szempontjából összehasonlítható volt. A kondroitin-szulfátot szedők által használt NSAID mennyisége egy év alatt a háziorvosok betegei esetében 63%-kal, a szakorvosok betegei esetében 85,3%-kal csökkent, és jelentősen csökkent a gyógyszeres kezelés költsége is, különösen ha az NSAID-ok mellékhatásainak és a mellékhatások kivédésének költségeit is beszámították.
Tarriconét (34) Conrozier vizsgálata (33) inspirálta, hogy kiszámolja, milyen hatása lenne az egészségügyi költségekre, ha arthrosis kezelésére NSAID helyett kondroitin-szulfátot alkalmazna. Az olasz nemzeti egészségügyi szolgálat adatai alapján állapította meg, hogy kondroitin-szulfát alkalmazása NSAID helyett milyen költségmegtakarítást jelentene. Erre számítógépes programot dolgozott ki, mely az olasz adatok helyett saját adatokat használva minden országban alkalmazható.
Olaszországban a 60 milliós népesség 20%-a, vagyis 12 millió ember szenved arthrosisban, s 67,7%-uk szed NSAID-ot. Feltételezve, hogy az NSAID-ot szedő betegek felét kondroitin-szulfáttal kezelik, a gyógyszerköltség – beleértve a gyomorvédő szerek költségét – 86 millió euróval, az NSAID-mellékhatások miatt szükségessé váló kórházi felvételek költsége 70 millió euróval, a háziorvosi vizitek és fizioterápia költsége 115 millió euróval csökkenne, vagyis összesen évi 255 millió eurót lehetne megtakarítani.
Ezt a modellt alkalmazzuk, megfelelő módosítással, a hazai viszonyokra, Tarricone (34) javaslata szerint: kidolgozott modelljében az egyes országok számadatait behelyettesítve országonként kiszámítható, hogy NSAID-kezelés helyett alkalmazott kondroitin-szulfát-kezeléssel milyen megtakarítás érhető el.
Mi sem a fizioterápiás költségeket, sem a háziorvoshoz fordulás költségeit nem vesszük számításba, mert gyógytorna kezelésre a betegnek mindenképpen szüksége van, s arthrosisos betegek háziorvoshoz fordulásáról van ugyan saját adatunk, (35) de mivel a kondroitin-szulfát hazánkban vényköteles, a betegnek a receptért meg kell jelennie a háziorvosnál, bár valószínűleg ritkábban.
Milyen eredményt ad hazai adatokkal a modell?
Hazánkban az OEP adatai alapján 2009-ben 8 millió 44 ezer doboz receptköteles NSAID fogyott, összesen 9,297 milliárd forint értékben. Ez közel 130 millió terápiás napot jelentett, és egy terápiás nap átlagos költsége 72 forint volt. Vény nélkül vásárolható NSAID-ból 4819000 doboz fogyott 4,474 milliárd forint értékben ugyanebben az évben. A 28,1 millió terápiás napnyi gyógyszer napi átlagköltsége 168 forint volt. Ha az összes 158,1 millió terápiás napot kitevő NSAID-ot vesszük számításba, ezek átlagos költsége napi 89,2 forint.
Az NSAID-felhasználás összességében nagyobb, mint a néhány évvel ezelőtti fogyasztás, amikor Gömör (36) évi 10 millió doboz NSAID-ban jelölte meg a hazai fogyasztást.
Ha feltételezzük, hogy a 13,771 milliárd forint értékű NSAID-ok 55%-át arthrosisos betegek részére rendelték, illetve szabadon vásárolható gyógyszerként arthrosisos betegek vették be, az 7,57 milliárd forint értékű gyógyszert jelent. Ez a becslés nagy valószínűséggel reális, hisz ha csak azt feltételezzük, hogy a szakorvosnál megjelent 1,6 millió beteg közül legalább 880000 fő szedett évente 90 napig NSAID-ot, ez átlagban 7,065 milliárd forintba került, pedig a szakorvoshoz nem kerülő, csak háziorvos által kezelt arthrosisos betegeket nem is vettük számításba, erre vonatkozó adat ugyanis nem létezik. Saját felmérésünk szerint a háziorvosok térd-arthrosisos betegeinek 54%-a, a reumatológusok térd-arthrosisos betegeinek 48%-a, átlagban a vizsgált betegek 50%-a szed folyamatosan NSAID-ot. (23)
Sajnos nincs adatunk arra, hogy hazánkban hány NSAID-ot szedő beteg részesül megfelelő gyomorvédelemben. Prónai (19) szerint a betegek 15%-a kap savcsökkentő gyógyszert, de csak 5%-uk protonpumpagátlót. Feltételezésünk szerint legalább a betegek 30%-a 65 éven felüli és/vagy szerepel az anamnézisében fekélybetegség, refluxbetegség, antikoaguláció, trombocitaaggregáció-gátló dózisú ASA-szedés. A protonpumpagátlók költsége OEP-adatok alapján napi 88 forint. Ha feltételezzük, hogy 330000 beteg szorul protonpumpagátlóra, ennek terápiás költsége 10,5 milliárd forint, vagyis több, mint az NSAID-kezelés költsége.
Nagy és Orosz (37) felmérése szerint 2009-ben hazánkban 13185 sürgősségi felső gasztrointesztinális endoszkópos vizsgálat és 4521 vérzéscsillapítás történt. Joggal feltételezhetjük, hogy e vizsgálatokra legalább 10000 esetben NSAID-mellékhatások miatt került sor. Ha az ambuláns gasztroszkópia OEP-finanszírozása 3050 forint, ennek költsége mindössze 30,5 millió forintot tesz ki. Egy NSAID okozta gasztropátia ambuláns ellátása Nagy-Britanniában 540 dollárba (108000 forint), Brazíliában 87 dollárba (17600 forint) kerül, vagyis lényegesen drágább, mint nálunk.
Prónai (19) becslése szerint hazánkban évente 5000 beteg kerül kórházba NSAID okozta gyomor-bél rendszeri szövődmények miatt. A szövődményes fekélybetegség HBCS-elvű térítése 127000 forint, így ez a költség összesen 635 millió forint.
A hazai arthrosisos betegek NSAID-kezelésének egyéves összegzett költsége az 1. táblázatban látható.

A receptköteles porcvédő gyógyszerek összköltsége 2009-ben 585 millió forint volt, ezen belül a kondroitin-szulfáté 268 millió forint. A kondroitin-szulfát egy terápiás napjának költsége: 88 forint.
Ez a költség 880000 NSAID-ot szedő arthrosisos betegre 12,584 milliárd forint, ha évi kétszer három hónapos periódussal számolunk. A megtakarítás így 4,981 milliárd forint, valamint 400 gasztrointesztinális vérzés okozta haláleset, hiszen a kondroprotekció nem követel halálos áldozatokat. A betegnek sajnos a kondroitin-szulfát-kezelés a drágább, mert ezt a társadalombiztosítás egyáltalán nem támogatja. Ennek dacára úgy gondoljuk, érdemes legalább az NSAID-ot szedő közel egymillió arthrosisos beteg felét kondroitin-szulfátra átállítani, és ez véleményünk szerint meg is valósítható. Ötszázezer beteg éves NSAID-költsége gyomorvédelemmel, illetve a szövődmények költségével 10,474 milliárd forint, míg a kondroitin-szulfát-kezelés ára 7,15 milliárd forint, vagyis több mint 3,3 milliárd forint így is megtakarítható (6. ábra).
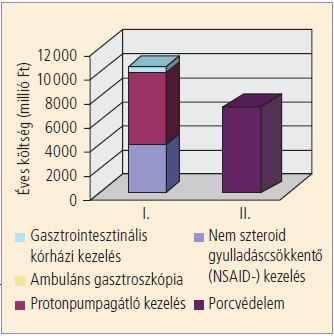
6. ábra. Az arthrosis kezelésének költségei Magyarországon
Ez azt jelenti, hogy ha az orvosi vizitek és a fizioterápia költségének csökkenésével nem is számolunk, és ha az NSAID-mellékhatások ambuláns és kórházi ellátásának költsége összehasonlíthatatlanul olcsóbb is hazánkban, mint az egyébként európai viszonylatban nem drága brit vagy éppen a brazil ellátás költsége, még így is olcsóbb a porcvédő, fájdalom- és gyulladáscsökkentő hatású kondroitin-szulfát szedése. Jelentős a megtakarítás már akkor is, ha csak az NSAID-ot szedő betegek felét állítjuk át NSAID-ról kondroitin-szulfátra. Saját felmérésünk szerint mind a háziorvosok, mind a reumatológusok térd-arthrosisos betegeinek fele szed folyamatosan NSAID-ot, ami rendkívül nagy mellékhatás-kockázattal jár. (23)
Ezen a gyakorlaton mindenképpen változtatni kell, hiszen a nemzetközi és a hazai ajánlások szerint is arra kell törekednünk, hogy minél rövidebb ideig alkalmazzuk az NSAID-okat. Ez akkor lenne igazán hatékonyan megvalósítható, ha az arthrosisos betegek a nemzetközi ajánlásoknak megfelelően előbb kapnának kondroprotektív gyógyszert, mint NSAID-ot. Ezt a terápiás szemléletmódot támogatják a szakmai ajánláson kívül a farmakoökonómiai számítások is.
A szerző a következő címre várja észrevételeiket: This e-mail address is being protected from spambots. You need JavaScript enabled to view it.
Irodalom:
1. Te Burden of Musculoskeletal Diseases in the United States. Bone and Joint Decade, 2000–2011, http://www.boneandjointburden.org/about/index.htm
2. European Action Towards Better Musculoskeletal Health. Bone and Joint Decade 2000 2010 Ann Rheum Dis 2000; 59(2):81-82
3. Woolf AD, Pfleger D. Burden of major muskuloskeletal conditions. Bull World Health Organ 2003;81:646–656
4. Murray CJ, Lopez AD. Evidence based health policy lessons from the Global Burden of Disease Study. Science 1996;274:740–743
5. Watson DJ, Rhodes T, Guess HA. All case mortality and vascular events among patients with rheumatoid arthritis, osteoarthritis and no arthritis in the UK. General Practice Research Database. J Rheumatol 2003;30:1196–1202
6. Az Országos Egészségbiztosítási Pénztár adatai
7. Health at a Glance: Europe. OECD, 2010. http://www.oecd.org/document/19/0,3746,en_2649_37407_46460563_1_1_1_37407,00.html
8. Jordan KM, Arden NK, Doherty M, et al. EULAR Recommendations 2003: an evidence based approach to the management of knee osteoarthrosis. Arth Rheum Dis 2003;62:1145 1155
9. Zhang W, Doherty M, Arden NK et al: EULAR evidence based recommendations for the management of hip osteoarthritis report of a task force of the EULAR Standing Committee for International Studies Including Therapeutics (ESCISIT), Ann Rheum Dis 2005;64:669–681
10. Zhang W, Doherty M, Leeb BF, et al. EULAR evidence based recommendations for the management of hand osteoarthritis; report of a Task Force of the EULAR Standing Committee for International Clinical Studies Including Therapeutics (ESCISIT). Ann Rheum Dis 2007;66:377–388
11. Zhang W, Moskowitz RW, Nuki G, et al. OARSI recommendations for the management of hip and knee osteoarthritis, Part II. OARSI evidence based, expert consensus guidelines. Osteoarthritis Cartilage 2008;16:137–162
12. Recommendations for the medical management of osteoarthritis of the hip and knee: 2000 update. American College of Rheumatology Subcommittee on Osteoarthritis Guidelines. Arthritis Rheum 2000;43:1905–1915
13. Moore RA, Derry S, Phillips CJ, McQuay HJ. Non-steroidal anti-inflammatory drugs (NSAID-s), cyclooxigenese-2 selective inhibitors (coxibs) and gastrointestinal harm review of clinical trials and clinical practice. BMC Musculoskeletal Disord 2006;7:79–84
14. Lanza FL. A review of gastric ulcer and gastrointestinal injury in normal volunteers receiving aspirin and other non-steroidal antiinflammatory drugs. Scand J Gastroenterol 1989;24 (Suppl 163):24–31
15. Straube S, Tramien MR, Moore RA, Derny S, McQuay HJ. Mortality with upper gastrointestinal bleeding and perforation: effect of time and NSAID use. BMC Gastroenterology 2009;4:41–48
16. Retail and Provide Perspective: National Prescription Audit, 1999–2000. Plymouth, Pa, IMS Health, 2000
17. Silverstein FE, Faich G, Goldstein SL, et al. Gastrointestinal toxicity with celecoxib vs. nonsteroidal antiinflammatory drugs for osteoarthritis and rheumatoid arthritis. The CLASS Study: a randomized double blind, placebo controlled trial. JAMA 2000;284:1247–1255
18. Singh G, Ramsey DR. NSAID-s induced gastrointestinal complications: the ARAMIS perspective, 1997. J Rheumatol 1998;25 (Suppl 51):8–16
19. Prónai L. A nem-steroid gyulladásgátlók emésztőrendszeri mellékhatásai fokozott kockázatú betegekben, a specifikus ciklooxigenáz gátlók szerepe. Orv Hetil 2001;142:1899 1905
20. Laine I. Approaches to non-steroidal antiinflammatoty drugs use in the high risk patients. Gastroenterology 2001;120:594–606
21. Yeomans ND, Tulassay Z, Juhász L, et al. A comparison of omeprezol and ranitidine for ulcers associated with non-steroidal antiinflammatory drugs. N Engl Med 1998;338:719–726
22. Taha AS, Hurison N, Hawkey CJ, et al. Famotidine for the prevention of gastric and duodenal ulcers by non-steroidal antiinflammatory drugs. N Engl J Med 1996;334:1435–1439
23. Bálint G, Szebenyi B, Héjj G, Kovács E, Poór Gy, Hodinka L. Pain functional impairment and quality of life in knee osteoarthritis in Hungary. Hungarian Rheumatology 2004;45 (Suppl):62
24. Rademacher J, Jeutsch D, Lustinecz T, Fröhlich J. Diclofenac concentration in synovial fluid and plasma after cuteneous application in inflammatory and degenerative joint disease. Br J Clin Pharmacol 1991;31:537–541
25. Rolf C, Engström B, Beuchard C, Jacobs LD, Le Liboux A. Intra-articular absorption and distribution of ketoprofen after topical plantar application and oral intake in 100 patients undergoing knee arthroscopy. Rheumatology 1999;38:564–567
26. Evans JM, McMahon AD, McGilchist MM, White G, et al. Topical non-steroidal antiinflammatory drugs and admission to hospital for upper gastrointestinal bleeding and perforation: a record linkage case control study. BMJ 1995;311:22–26
27. Bellamy N, Campbell J, Robison V, et al. Intraarticular corticosteroid for treatment of osteoarthritis of the knee. Cochrane Database, Syst Rev 2006, CD 005328
28. Caborn D, Rush J, Lanzer W, et al. A randomized single blind comparison of the efficacy and tolerability of hylen G-F20 and triamcinolon hexacetonide in patients with osteoarthritis of the knee. J Rheumatol 2004;31:333–343
29. Kahan A, Uebelhart D, De Varhaine E, et al. Long-term effects of chondroitin 4 and 6 sulfate on knee osteoarthritis: the study on osteoarthritis progression prevention, a two-year, randomized, double-blind, placebo-controlled trial. Arthritis Rheum 2009;60:524–533
30. Michel BA, Stucki G, Frey D, et al. Chondroitins 4 and 6 sulfate in osteoarthritis of the knee a randomized controlled trial. Arthritis Rheum 2005;52:779–786
31. Bucsi L, Poór G. Efficacy and tolerability of oral chondroitin sulfate as a symptomatic slow acting drug for osteoarthritis (SYSADOA) in the treatment of knee osteoarthritis. Osteoarthritis Cartilage 1998;6 (Suppl A):31–36
32. Wildi LM, Raynauld J-P, Martel-Pelletier J, et al. Chondroitin sulphate reduces both cartilage volume loss and bone marrow lesions in knee osteoarthritis patients starting as early as 6 month after initiation of therapy: a randomised, double-blind, placebo-controlled pilot study using MRI. Ann Rheum Dis 2011, doi 10.1136/ard.2010.140848
33. Conrozier Th. Les chondroitines sulfates (CS 4-6) scheme d’utilization, et impact économique. La Presse Medicale 1998;27:1866–1868
34. Tarricone R. Treatment innovation for Osteoarthritis. A Budget Impact Analysis for Chondroitin Sulphate and NSAIDs. Eur Musculoskel Rev 2009;4:oldalszám?
35. Bálint G, Héjj G, Ratkó I, Fabó T, Penczner G, Gömör B. Gyulladásos és degeneratív ízületi és gerincbetegségekben szenvedők életminőségének vizsgálata Magyarországon. M Reumatol 1995;36:5–13
36. Gömör B. Szelektív ciklooxigenáz (COX-2) gátlás. Orv Hetil 1999;140:396–399
37. Nagy Gy, Orosz P. Jelentés a 2009. évi magyarországi gasztroenterológiai endoszkópos tevékenységről. LAM 2010;20(6-7):395–397
38. Szebenyi B, Szende A, Lovas K, Balint G, Hodinka L, Hejj G. Health-related quality of life in patients with hip and knee osteoarthritis in Hungary. Rheumatology 2002;41(Suppl 1):123






