Új szer gyermekkori Lambert-Eaton szindróma ellen
Az FDA 2019. május 6-án engedélyezte a 6-17 éves gyerekek Lambert-Eaton szindrómájának kezelésére szolgáló Ruzurgi (amifampridin) készítményt, melynek hatóanyaga azonos a decemberben engedélyezett Firdapse tablettáéval.
Az Egyesült Államok Élelmiszer és Gyógyszer Hatósága (FDA) 2019. május 6-án engedélyezte a 6-17 éves gyerekek Lambert-Eaton myasthenia szindrómájának (LEMS) kezelésére javallott Ruzurgi (hatóanyag: amifampridin, gyógyszerforma: 10 mg tabletta) nevű készítményt (kérelmező: Jacobus Pharmaceutical Company Inc.), melynek hatóanyaga megegyezik az FDA által tavaly decemberben jóváhagyott Firdapse tablettáéval (Catalyst Pharmaceuticals Inc.). A Ruzurgi különlegessége pont az indikáció, mivel gyerekkorú betegek számára korábban nem volt engedéllyel rendelkező készítmény. Az FDA a Ruzurgi engedélykérelmét elsőbbségi felülvizsgálati eljárás (priority review) keretében, a normál eljárásnál szokásos 10 hónap helyett 6 hónap alatt vizsgálta meg. A készítmény fast track (fejlesztés során nyújtott segítség, lásd lent) és ritka betegségek gyógyszere (orphan medicine) jelölést is kapott. Az Európai Unió területén az igen hasonló, ám felnőtt betegek kezelésére engedélyezett gyógyszer, a Firdapse forgalmazása 2009. december 23. óta engedélyezett (2010-ig még Zenas kereskedelmi néven), a forgalomba hozatali engedély jogosultja a BioMarin International Limited (Írország).
A hatóanyagról (amifampridin)
Az amifampridin blokkolja a feszültségfüggő káliumcsatornákat, megnyújtva ezzel a preszinaptikus sejtmembrán depolarizációját. Az akciós potenciál megnyújtása elősegíti a kalcium transzportját az idegvégződésbe. Az intracellularis kalciumkoncentráció ebből következő emelkedése elősegíti az acetilkolint tartalmazó vezikulák exocitózisát, ami így elősegíti a neuromuscularis transzmissziót. Ez növeli az izomerőt és a nyugalmi összetett izom akciós potenciál (compound muscle action potential – CMAP) amplitúdóját, 1,69 mV-nak megfelelő (95% CI, 0,60–2,77) összesített súlyozott átlagkülönbséggel.
A Lambert-Eaton myasthenia szindróma (LEMS)
A LEMS egy igen ritka autoimmun betegség, melyet az acetil-kolin felszabadulását gátló ellenanyag okoz a feszültségfüggő kalcium-csatornák blokkolásával, az ellenagyag a betegek 90%-ában kimutatható. Ez különbözteti meg a myasthenia gravistól, ahol az antitestek az acetil-kolin receptorokat támadják meg. Becslések szerint a LEMS egymillió emberből mindössze hármat érint, igen gyakran társul kissejtes tüdőrákkal (SCLC, small cell lung cancer), és a tüdőrák diagnózisát évekkel megelőzheti. Magyarországon a Dél-Pesti Kórházban 10 év alatt mindössze 3 betegnél állapították meg. Jellemzője a néhány hét alatt kialakuló járászavar, lábgyengeség (járókeret szükséges), areflexia, a combot és a csípőt gyakrabban érinti, mint a vállakat vagy a felkart. Az érintett izmok gyorsan elfáradnak, merevség, görcs állhat be. Egyes esetekben érintheti a szemhéj- és szemmozgató izmokat is, ilyenkor a szemhéj félig lecsukódik (ptosis), és kettős látás (diplopia) alakulhat ki. A jelenséget szájszárazság, férfiaknál impotencia kísérheti, idősebb, főleg dohányzó betegeknél komoly az esélye a kissejtes tüdőrák kialakulásának (vagy már ki is mutatható), míg fiatalabb betegeknél tüdőrák jellemzően nem kíséri a betegséget. A tünetegyüttes progressziója lassú, az izmokban érzékelt gyengeség és a fáradtság mértéke napról-napra változhat. Stressz, hőség és alváshiány súlyosbíthatja a tüneteket. A klinikai gyakorlatban a betegséget kolinészteráz-gátlókkal (jellemzően piridosztigminnel), és immunszuppresszánsokkal (intravénás immunglobulin) is kezelik, de a leghatásosabbnak tekintett terápia a káliumcsatorna-blokkolók alkalmazása.
Mellékhatások
Gyerek és felnőtt korú betegeknél a leggyakrabban tapasztalt mellékhatások a Ruzurgi szedése során a következők voltak: égő vagy szúró érzés (paresthesia), hasi fájdalom, emésztési zavarok, szédülés és émelygés. A gyerekeknél jelentett mellékhatások igen hasonlóak voltak a felnőtt korú betegeknél regisztrált mellékhatásokhoz. Egyes ritka esetekben rohamokat is tapasztaltak olyan betegeknél, akik kórelőzményében rohamok nem szerepeltek.
Tanmese a kapzsiságról, avagy bukta Catalyst módra
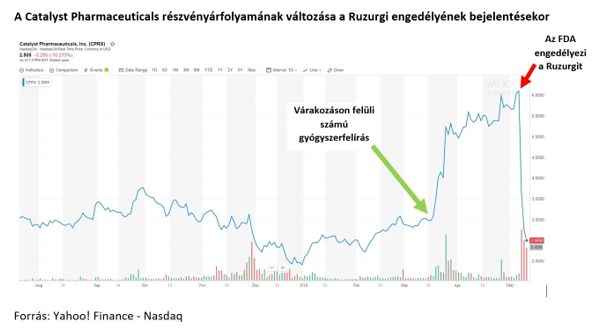
Az Egyesült Államokban a Lambert-Eaton szindrómában szenvedő betegek körében (ez a 327 milliós népességű USA-ban 400 embert jelent) óriási felháborodást váltott ki, hogy a tavaly decemberben engedélyezett Firdapse készítmény gyártója, a Catalyst Pharmaceuticals Inc bejelentette: a gyógyszert 375 ezer dolláros áron fogja piacra dobni. A tőzsdén azonban a Catalyst részvényárfolyama szárnyalni kezdett, mivel még a cég előzetes elvárásait is meghaladó számú gyógyszerfelírást regisztráltak. Csakhogy a korábban az elnökségért is ringbe szálló Bernie Sanders, Vermont állambeli demokrata szenátor dörgedelmes hangvételű levelet írt a vállalatnak, melyben a „lehető legkárosabb vállalati kapzsiság mintapéldájának” nevezte az esetet. Ezen felül felszólította a Jacobus Pharmaceutical Company Inc. nevű kis céget, amely korábban, már a Firdapse FDA-engedélyének kiadása előtt is évtizedeken keresztül gyártotta a szert, ám a készítményt ingyen, egy méltányossági program keretében, rászorultsági alapon adta a betegeknek, hogy ne hagyjon fel a gyógyszer gyártásával.
A Jacobus pedig nem állt le, és külön gyerekek számára is engedélyeztette a szert, pedig becslésük szerint az Egyesült Államokban legfeljebb 15 gyerek szenvedhet a betegségben. Május 6-án, azaz azon a hétfői napon, amikor az FDA megadta az engedélyt a Ruzurgi számára, a Catalyst Pharmaceuticals részvényei óriásit buktak, árfolyamuk 50%-ot esett. Ennek oka, hogy bár a Ruzurgi az indikáció szerint csak 6-17 év közötti gyermekeknél használható, az Egyesült Államokban szokásos eljárás szerint amennyiben az orvos úgy ítéli meg, hogy a beteg számára ez indokolt, javasolhatja a Ruzurgi off-label alkalmazását, vagyis a felnőtt betegek is hozzájuthatnak a gyógyszerhez (egyébként ez az oka annak, hogy az USA-ban gyakorlatilag bármilyen betegségre bármilyen gyógyszer felírható, ha az orvos úgy ítéli meg). Laura Jacobus, a Jacobus Pharmaceuticals tulajdonosa egyelőre nem nevezte meg a Ruzurgi árát, de már tett egy olyan nyilatkozatot, miszerint biztosítani akarja, hogy minden beteg meg tudja engedni magának a gyógyszert. Általában nem divat, hogy az Egyesült Államokban az egészségbiztosítók valamely készítmény off-label használatát finanszíroznák, ám a Ruzurgi és a Firdapse ára közötti különbség miatt a Ruzurgi várhatóan sokkal ésszerűbbnek fog tűnni számukra, különösen, hogy teljesen azonos hatóanyagú és dóziserősségű készítményekről van szó (mindkettő 10 mg amifampridint tartalmazó tabletta).
A történteket követően Bernie Sanders szenátor üdvözölte az FDA döntését, mondván „egyetlen betegnek sem kell aggódnia amiatt, hogy egy gyógyszercég obszcén mértékű profitjának emelkedése miatt fog szenvedni vagy meghalni. Ez a hét a LEMS-ben szenvedő betegek és az amerikai adófizetők győzelmét hozta, és csapást mért a Big Pharma kapzsiságára”. Ami még érdekes a történetben, az a Catalyst Pharmaceuticals szóvivőjének, David Schullnak a nyilatkozata, aki így fogalmazott: „a vállalat továbbra is arra összpontosít, hogy a Firdapse készítmény folyamatos piaci értékesítésével biztosítsa a szükséges gyógyszert a betegek számára, köztük azon betegeknek, akik nem részesülhettek kezelésben a gyógyszer FDA-engedélyének kiadását megelőzően.” A vállalat hivatalos kommünikéje szerint a Firdapse engedélyezését megelőzően a nagyjából 3000 amerikai LEMS betegből mindössze 200 jutott hozzá a készítményhez, ráadásul ezeknek a betegeknek is rengeteg adminisztrációba került, hogy megkapják a gyógyszert.
Fast Track jelölés – Az FDA már a gyógyszer fejlesztése során segítséget nyújt, később pedig az engedélyezési folyamatot is felgyorsítja, ha az új szer súlyos állapotok (pl. AIDS, Alzheimer-kór, szívelégtelenség, rákos megbetegedések, epilepszia, depresszió, cukorbetegség, de egyedi elbírálás alapján más állapot is lehet) kezelésére szolgál, vagy ha kielégítetlen gyógyászati szükségletet lát el.
Priority Review – Ha egy gyógyszert ebbe a kategóriába sorolnak, akkor az FDA 6 hónapon belül döntést hoz az engedélyezésről. Ennek ellentéte a Standard Review, ahol az elbírálás 10 hónapot vesz igénybe.
Orphan medicine – Az FDA a kevesebb, mint 200 ezer embert érintő súlyos, életet veszélyeztető betegségek esetén adja meg ezt a jelölést, amikor nem várható, hogy a befektetett kutatási és fejlesztési összeg az Egyesült Államokban történő forgalmazás során megtérül.
Írásunk az alábbi közlemények alapján készült:
FDA Approves Ruzurgi (amifampridine) for Children with Lambert-Eaton Myasthenic Syndrome
FDA approves Ruzurgi for children with Lambert-Eaton myasthenic syndrome
FDA undercuts $375,000 drug in surprise move
Why Catalyst Pharmaceuticals Is Getting Crushed Today
First, a pricing scandal for Catalyst's Firdapse. Next, off-label competition?







