Súlyos hipoglikémia elleni orrspray
Az EMA CHMP pozitívan véleményezte a súlyos hipoglikémia kezelésére szolgáló Baqsimi (glukagon) készítményt.
Az Európai Gyógyszerügynökség emberi felhasználásra szánt gyógyszerekkel foglalkozó bizottsága (CHMP) október 17-én pozitív véleményt fogalmazott meg a súlyos hipoglikémia kezelésére szolgáló Baqsimi (hatóanyag: glukagon, gyógyszerforma: 3 mg-os egyszer használatos orrspray) készítményre (kérelmező: Eli Lilly Nederland B.V.) Az újdonságot a gyógyszerforma jelenti, mivel a súlyosan alacsony vércukorszintű betegeknek gyorsan kell beadni a készítményt, és gyakori, hogy a beteg a hipoglikémia miatt eszméletlen, így a szájon át történő gyógyszerbevitel nem mindig lehetséges.
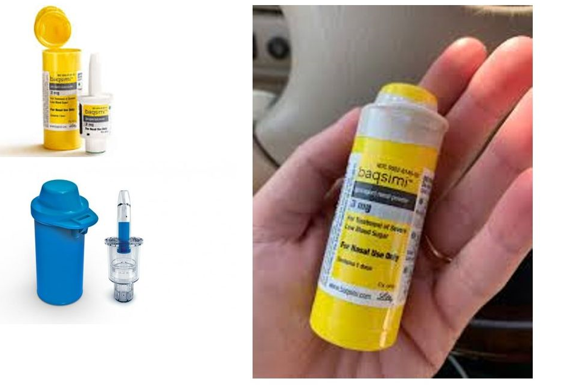
A Baqsimi orrspray adagolója a készítményt védő dobozzal
Az egyszer használatos, egy adagot tartalmazó orrspray előnye, hogy a dozírozást nem lehet elrontani, de sokkal fontosabb, hogy magatehetetlen betegnek is beadható, mert a hatóanyag az orr nyálkahártyáján keresztül szívódik fel. A készítmény beadásához a gyógyszert adagoló személynek az adagoló alján található dugattyút kell megnyomnia, és a por a beteg orrnyálkahártyájára kerül. A Baqsimi adagolóját az Aptar Pharma készítette és az Unidose Powder System nevet viseli, mérete miatt 4 évesnél idősebb gyermekeknél alkalmazható. A Baqsimi az Egyesült Államokban 2019. július 24-e óta engedélyezett, és a közelmúltban az FDA jóváhagyott egy hasonló készítményt Gvoke néven, ennél nem orrspray, hanem előre töltött injekciós toll alkalmazásával lehet beadni az adagot.
A hatóanyagról (glukagon)
A Baqsimi hatóanyaga a glukagon (ATC kód: H04AA01), egy hasnyálmirigy által termelt hormon, mely a vércukorszintet növeli, azaz hatása ellentétes az inzulinéval. Súlyos fokú hipoglikémiáról akkor beszélünk, ha a vércukorszint 3,5 mmol/l alá süllyed, ez leggyakrabban cukorbetegeknél, túlzott inzulinadagolás következtében fordul elő.
Klinikai vizsgálatok
A Baqsimi hatásosságát és biztonságosságát felnőtteknél két klinikai vizsgálatban értékelték, amelyeket 70 ill. 83 beteg bevonásával végeztek. A betegeknél inzulinnal hipoglikémiát idéztek elő, és az eredmények szerint a Baqsimi a beadását követő 30 percen belül hatásosan és biztonságosan emelte meg a vércukorszintet. Végeztek egy klinikai vizsgálatot 4 évnél idősebb 1-es típusú cukorbetegségben szenvedő gyerekek körében is (48 beteg bevonásával), ahol hasonló eredményeket kaptak.
Mellékhatások
A Baqsimi alkalmazása során tapasztalt leggyakoribb mellékhatások a fejfájás, hányinger, hányás, a felső légutakban jelentkező irritáció, a szemek bevörösödése és a viszketés voltak. A mellékhatások egyébként megegyeznek a hagyományos módon beadott glukagonnál tapasztaltakkal, a Baqsimi esetében a szem bevörösödése és az orrkörnyéki tünetek a speciális beadási forma miatt jelenhetnek meg.
Az emberi felhasználásra szánt gyógyszerek bizottsága (CHMP) által az októberi ülésen adott pozitív vélemény a forgalmazási engedély kiadásának érdekében lefolytatott eljárás egyik legfontosabb állomása. A CHMP állásfoglalása most az Európai Bizottság elé kerül, és az intézmény dönt az uniós forgalomba hozatali engedély kiadásáról a CHMP pozitív véleményének kiadásától számított 67 napon belül. A termék alkalmazásával kapcsolatos részletes információkat az alkalmazási előirat (SmPC - Summary of Product Characteristics) tartalmazza majd, mely az Európai Unió összes hivatalos nyelvén elérhető lesz, amint az Európai Bizottság kiadja a forgalomba hozatali engedélyt. A forgalomba hozatali engedély kiadását követően az egyes uniós országok tagállami szinten döntenek majd a készítmény áráról és támogatásáról, figyelembe véve a gyógyszernek az adott ország nemzeti egészségügyi rendszerében betöltött várható szerepét, felhasználását.
Írásunk az alábbi közlemények alapján készült:
Summary of Opinion (SMOP)– Baqsimi (EMA)
First non-injectable treatment for severe low blood sugar levels
Meeting highlights from the Committee for Medicinal Products for Human Use (CHMP) 14-17 October 2019
FDA approves Baqsimi nasal powder, first treatment for severe hypoglycemia without an injection
Powder-Delivery Device Approved for First and Only Nasally Administered Glucagon







