Erenumab migrén megelőzésre
Az Európai Gyógyszerügynökség emberi felhasználásra szánt gyógyszerekkel foglalkozó bizottsága (CHMP) pozitívan véleményezte a migrén megelőzésére szolgáló Aimovig (erenumab) készítményt.
Az Európai Gyógyszerügynökség emberi felhasználásra szánt gyógyszerekkel foglalkozó bizottsága (CHMP) május 30-án pozitív véleményt fogalmazott meg a felnőtt betegekben migrén megelőzésére szolgáló Aimovig (erenumab) készítménnyel szemben (kérelmező: Amgen). A szer forgalmazását az Egyesült Államok Élelmiszer és Gyógyszer Hatósága, az FDA két héttel korábban, május 17-én hagyta jóvá. Ez az első olyan készítmény, mely hatásmechanizmusa szerint humán monoklonális antitesteket használ a kalcitonin-génnel rokon peptid receptor (CGRP-R) blokkolására. – mely jelenlegi ismereteink szerint meghatározó szerepet játszik a migrén kialakulásában.
Az Aimovig 70 mg készítményt a beteg saját magának adhatja be havonta egyszer az Amgen SureClick® autoinjektorával, és nincs szükség feltöltő dózisra. Egyes betegeknél havi 140 mg-os adag ajánlott.
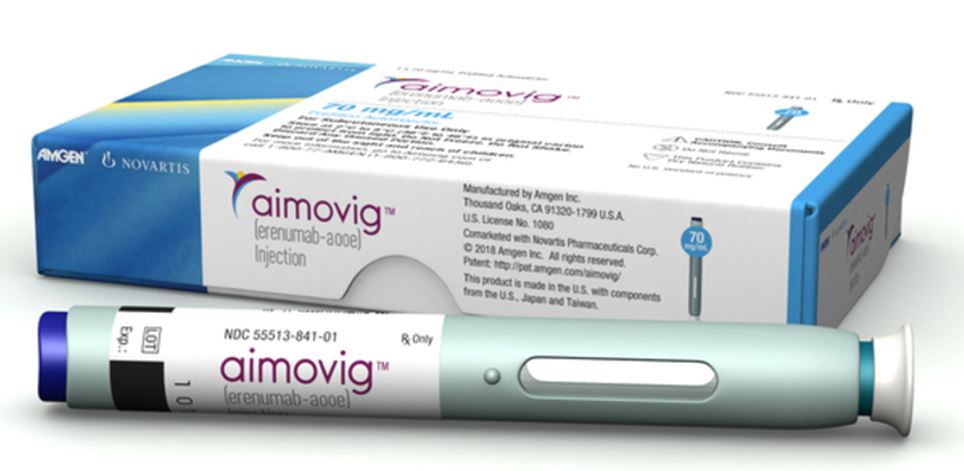 Az Aimovig és a SureClick® injekciós toll
Az Aimovig és a SureClick® injekciós toll
Érdekesség továbbá, hogy a készítmény az Amgen és a Novartis 2015-ben kötött globális stratégiai együttműködése révén jött létre, melynek célja a migrén és az Alzheimer-kór (44 millió beteg világszerte) elleni hatóanyagok fejlesztése, ezért látható az Aimovig csomagolásán a Novartis neve is. Kísérleti fázisban van már egy másik hatóanyag is, az AMG 301 kódnevű monoklonális antitest, mellyel kapcsolatosan jelenleg fázis II. vizsgálatok folynak.
A CHMP döntését két pivotális vizsgálat adatai alapján hozta meg, melyekbe összesen 667 krónikus migrénben és 955 epizodikus migrénben szenvedő beteget vontak be. Három hónapos kezelést követően a krónikus migrénben szenvedő betegeknél a fejfájásos napok száma átlagosan havonta 2.5-tel csökkent, míg az epizodikus migrénben szenvedő betegeknél a csökkenés a dózistól függően havi 1,3-1,8 nap volt a placebóhoz képest.
A leggyakoribb megfigyelt mellékhatások az injekció beadási helyén jelentkező reakciók, székrekedés, izomgörcsök és viszketés voltak.
Az FDA a készítményt a hatásosságának, tolerálhatóságának és biztonságosságának vizsgálatára globálisan végzett Aimovig klinikai vizsgálati program alapján engedélyezte, melybe négy fázis II. valamint fázis III. klinikai vizsgálat tartozott, összesen több mint 3000 beteg bevonásával. A fázis IIIb. LIBERTY (NCT03096834) multicentrikus, randomizált, 12 hetes, kettős-vak, placebo-kontrollos vizsgálatba 246 „nehezen kezelhető” (azaz legalább 4 korábbi migrénmegelőző kezelésre nem kielégítő választ adó), epizodikus (kiinduláskor 4-14 migrénes nap/hó) migrénben szenvedő betegek vontak be., és őket randomizálták 140 mg Aimovig vagy placebo csoportokba a 12 hetes kettős-vak kezelési időszakban. Az elsődleges végpont azon betegek százalékos aránya volt, akiknél a vizsgálat utolsó 4 hetében (9-12. hét) a kiinduláskori állapothoz képest legalább 50%-kal csökkent a havonkénti migrénes napok száma. Az eredmények szerint az epizodikus migrénben szenvedő betegeknek a placebóhoz képes csaknem háromszor nagyobb esélyük van arra, hogy a kiinduláskori állapothoz képest a migrénes napok száma legalább a felére csökkenjen.
A migrénről
A migrén egy súlyos neurológiai betegség, mely meghatározóan befolyásolja a betegek életét. A típusos migrénes fejfájás egyoldali, lüktető-görcsös jellegű, a fájdalom intenzitása az enyhétől a súlyos mértékig terjed, melyet a fizikai aktivitás kifejezetten ront. A fájdalom lehet kétoldali (az esetek 40%-ában) vagy az egyik oldalon kezdődik, de a későbbiekben átterjed az ellenoldalra és bilaterálissá válik. A migrénes fejfájás a nap minden szakában kialakulhat, de leggyakrabban a reggeli órákban jelentkezik. Fokozatosan fejlődik ki és 4-72 órán át tart. A fájdalomhoz a betegek 90%-ában hányinger és 1/3-ában hányás csatlakozik. Gyakran társul a fejfájáshoz photo- és phonophobia, sápadtság, a szemhéj-arc ödémásodása, hideg-melegségérzés és a nyaki izmok merevsége. A beteg ráadásul retteg attól, hogy mikor jön a következő roham. A Lancet folyóiratban megjelent 2016-os Globális Betegségteher Vizsgálat (The 2016 Global Burden of Disease Study) a migrént a 10 legtöbb betegségteherrel eltöltött évet okozó betegség közé sorolta, melyet még napjainkban sem ismernek fel és kezelnek súlyosságának megfelelő mértékben.
Egyelőre nem tudni, hogy a készítmény az egyes uniós országokban milyen TB-finanszírozást fog kapni, de a 70 vagy 140 mg-os előre töltött SureClick® automata fecskendőkben forgalmazott gyógyszer listaára az Egyesült Államokban havi 575 USD (kb. 155 ezer Ft), vagy évi 6900 USD (csaknem 1,9 millió Ft), amit viszont a betegbiztosítás akár havi 5 dollárra (kb. 1400 Ft) csökkenthet.
Írásunk az alábbi közlemények alapján készült:
EU Panel Endorses Erenumab for Migraine Prevention
Dr. Tajti János – MTA doktori értekezés - A migrén kórfolyamatának vizsgálata