Ebola Zaire vírus elleni oltóanyag - frissítve
Az Egyesült Államokban szeptemberben megindított engedélyezési eljárást követően az Európai Gyógyszerügynökség emberi felhasználásra szánt gyógyszerekkel foglalkozó bizottsága (CHMP) is pozitívan véleményezte az Ebola Zaire vírus által okozott vérzéses láz megelőzésére szolgáló Ervebo (élő Ebola Zaire vírus) oltóanyagot.
- Ebola Zaire vírus elleni oltóanyag
- Az antropocén új kórokozói
- A világot fenyegető egészségügyi problémák
- Szuperpathogének kialakulása
- A vírusevolúció újfajta szemlélete
- A védőoltások jelentősége – bevezető
- Tünetmentes Ebola terjed Nyugat-Afrikában
- Az Ebola-vírus 470 nap után is fertőzőképes
- Gyors Ebola-teszt
Az Európai Gyógyszerügynökség emberi felhasználásra szánt gyógyszerekkel foglalkozó bizottsága (CHMP) október 17-én pozitív véleményt fogalmazott meg az Ebola Zaire vírus fertőzésének megelőzésére szolgáló Ervebo (hatóanyag: élő Ebola Zaire vírus, gyógyszerforma: injekciós oldat) készítményre (kérelmező: Merck Sharp & Dohme B.V.) A teljes indikáció szerint az Ervebo 18 éves vagy idősebb személyek aktív immunizálására javallott a Zaire Ebolavírus által okozott ebola vérzéses láz ellen. Az oltóanyagot az EMA gyorsított értékelési eljárás (accelerated assessment) keretében végezte, amire a 26/2004/EK 14(9) rendelet ad lehetőséget olyan szerek esetében, amelyek közegészségügyi szempontból, és különösen a terápiás innováció szempontjából nagy jelentőséggel bírnak. Ennél az eljárásnál a normál engedélyezési folyamat nettó 210 napos időtartamával szemben 150 nap alatt hoz döntést a hatóság. Az első 120 napot követően normál eljárás esetén az EMA kérdéseket fogalmazhat meg a szerrel kapcsolatban, amelyekre a kérelmezőnek válaszolnia kell, ez az úgynevezett „Stop Clock” fázis, ami a jelen esetben alkalmazott gyorsított engedélyezés esetén kimarad. A CHMP pozitív végső tudományos véleménye után az Európai Bizottságnak 67 napja van döntést hozni (decision), ekkor születik meg a hivatalos forgalomba hozatali engedély. Az FDA 2019. szeptember 17-én hozott döntést arról, hogy befogadja, és elsőbbségi engedélyezési eljárás (priority review) keretében vizsgálja a készítményt. Az amerikai engedélyezés várható időpontja 2020. március 14. Az FDA 2016 júliusában már áttörést jelentő terápia minősítést (breakthrough therapy designation) adott a vakcina számára.
Az emberi felhasználásra szánt gyógyszerek bizottsága (CHMP) által az októberi ülésen adott pozitív vélemény a forgalmazási engedély kiadásának érdekében lefolytatott eljárás egyik legfontosabb állomása. A CHMP állásfoglalása most az Európai Bizottság elé kerül, és az intézmény dönt az uniós forgalomba hozatali engedély kiadásáról a CHMP pozitív véleményének kiadásától számított 67 napon belül. A termék alkalmazásával kapcsolatos részletes információkat az alkalmazási előirat (SmPC - Summary of Product Characteristics) tartalmazza majd, mely az Európai Unió összes hivatalos nyelvén elérhető lesz, amint az Európai Bizottság kiadja a forgalomba hozatali engedélyt. A forgalomba hozatali engedély kiadását követően az egyes uniós országok tagállami szinten döntenek majd a készítmény áráról és támogatásáról, figyelembe véve a gyógyszernek az adott ország nemzeti egészségügyi rendszerében betöltött várható szerepét, felhasználását.
A hatóanyagról (élő Ebola vírus)
Az Ervebo hatóanyaga élő attenuált rekombináns vezikuláris sztomatitisz vírus (rVSV), amelyen a VSV köpenyén található glikoproteint Zaire Ebolavírus (ZEBOV) köpenyfehérjével cserélték ki, tehát a készítmény egy virális vakcina (ATC kód: J07BX02), amely aktív immunizációt biztosít a vírus fertőzése ellen.
Az oltóanyagot eredetileg a kanadai közegészségügyi hivatal fejlesztette ki, a Merck (MSD) a NewLink Genetics Corporation-tól vásárolta meg 2014-ben, és azóta több külső partnert is bevonva számos fejlesztést hajtott végre a vakcinán, illetve több kormányzati szervvel együttműködve klinikai vizsgálati programot is létesített. Az együttműködő hatóságok, intézmények közé tartozott többek között az FDA, az USA Egészségügyi Minisztériumához tartozó orvosbiológiai kutatás-fejlesztésért felelős hatóság (BARDA, Department of Health and Human Service’s Biomedical Advanced Research Development Authority), valamint a Védelmi Minisztérium, azaz a hadsereg által koordinált Fenyegetéscsökkentő Ügynökség (DTRA, Department of Defense’s Defense Threat Reduction Agency), mely kifejezetten a tömegpusztító kémiai és biológiai fegyverek, hackertámadások, nukleáris fenyegetések ellen, azok megelőzése érdekében végzi tevékenységét. Az oltóanyag alkalmazása során leggyakrabban tapasztalt mellékhatások az injekció beadási helye kerül jelentkező reakciók (fájdalom, duzzanat és bőrpír), fejfájás, láz, izom- és ízületi fájdalom valamint kimerültség voltak.
Az oltóanyagot előállító üzem Németországban található, és a gyógyszeripari vállalat már megkezdte a vizsgálati készítmény felhalmozását azokban az országokban, amelyek a leginkább érintettek lehetnek egy hirtelen, váratlan járványkitörésben, azaz főleg a Kongói Demokratikus Köztársaság területén és a szomszédos államokban.
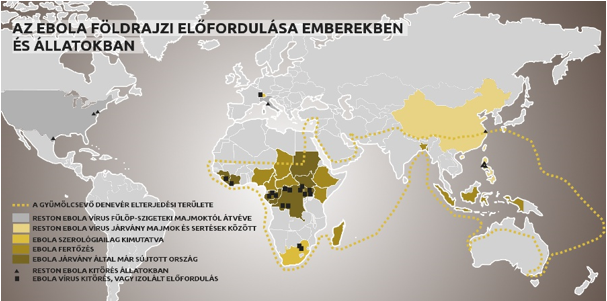
Az ebola vérzéses lázról
A vírust a Kongói Demokratikus Köztársaság (egykori nevén Zaire) területén található Ebola folyó völgye után nevezték el (a folyót az őslakosság saját nyelvén Legbala néven emlegeti), ami közel található az első 1976-os ismert járványkitöréshez, egy flamand nővérek által vezetett misszionárius kórházhoz Yambuku faluban. Az első két Ebola vírus fajt eredetileg 1976-ban két, szimultán járvány során fedezték fel Szudánban (Sudan ebolavirus) illetve a mai Kongói Demokratikus Köztársaság területén (Zaïre ebolavirus). A betegség okozói az Ebolavirus nemzetségbe tartozó Ebola-vírusok, melyek közül jelenleg öt ismert. Az Ebola-vírusok a Filovírusok családjába tartoznak, a család másik fontos képviselője az ugyancsak vérzéses lázat okozó Marburg-vírus. A Filovírusok, így az Ebola-vírusok is, lineáris, nem-szegmentált, negatív egyszálú RNS-t tartalmaznak, amihez kovalensen nem kapcsolódnak fehérjék. A virális genom kb. tizenkilenc kilobázis hosszúságú és hét gént tartalmaz, ezek 3'-5' irányban az NP, a VP35, a VP40, a GP, a VP30, a VP24 és az L gének. A különböző típusú Ebola-vírusok nukleotid szekvenciái különböznek egymástól, és változó mennyiségű génátfedést tartalmaznak. Az ebola vírusgazdája a mai napig ismeretlen, de nagy valószínűséggel a gyümölcsevő denevér az. A vírusgazda jellemzője, hogy immunis a vírusra, és eddig egyedül a gyümölcsevő denevérben mutatták ki az ebolát úgy, hogy az nem produkálta a tüneteket.
1976 óta több mint 20 járvány volt Közép-Afrikában, aminek e jelentős részét a Zaire ebolavirus okozta, amely a legmagasabb halálozási mutatóval rendelkezik (akár 90%). Az élővilág rezervoárszerepe a betegség elterjedésében még nem tisztázott, de bizonyítékok vannak, hogy az egyik hordozó a gyümölcsevő denevér. A vírus eredetileg egy fertőzött állatról került át emberre, majd emberről-emberre olyan testnedvekkel: vérrel, vizelettel, izzadtsággal, spermával, anyatejjel történő érintkezés útján terjedt. A lappangási idő 2-21 nap. A betegséget a lázas, valamint az azt követő szakaszok folyamán adja tovább a beteg, akár holtában is. A vírust a betegség lezajlása után 61 nappal is ki lehetett mutatni spermából. A betegséget leggyakrabban az Ebola RNS-ének, vagy antitestjeinek kimutatásával diagnosztizálják. A WHO 2015 márciusában engedélyezte az első Ebola-gyorsteszt használatát a fokozottan érintett országokban. Bár a ReEBOV antigén gyorsteszt nem olyan pontos, mint a nukleinsav próba, de 15 percen belül eredményt ad. A diagnózis pedig - tekintve a betegség igen súlyos lefolyását - életmentő lehet. A kezelés támogató jellegű, azaz nincs elfogadott terápiás módszer a betegség kezelésére. Kórházban az elveszett elektrolitok orális és intravénás pótlása, valamint láz- és fájdalomcsillapítás, a bélbántalmak enyhítése folyik. Az esetleges kísérő betegségek és fertőzések kezelése szintén fontos. A 2013 és 2016 közötti időszakban több tízezer embert betegített meg az Ebola vírusa Nyugat-Afrikában, ami az eddigi legnagyobb és leghosszabb járvánnyá nőtte ki magát. Azonban a bejelentett esetek száma (durván 28000) talán valójában jóval kisebb, mint a fertőzöttek tényleges száma, mivel csak a tünetekkel kísért megbetegedések jutottak a hatóság tudomására.
Az Ebola-vírusnak öt altípusa ismert: négy afrikai – Zaire Ebola-vírus, Sudan Ebola-vírus, Tai Forest Ebola-vírus, Bundibugyo Ebola-vírus – és egy, a Csendes-óceán nyugati parti területein előforduló Reston Ebola-vírus (csak tünetmentes fertőzést okoz). Kísérletek alapján a vírus nem nagyon ellenálló, napfény, kiszáradás, klór, szappan elpusztítja, de bizonyos felületeken (pl. üveg), alacsony hőmérsékleten (4°C) a kórokozó 50 napig is fertőzőképes marad. Magasabb hőmérsékleten (pl. szobahőmérséklet) vagy más felületeken (fém, műanyag, gyapjú) a kórokozó túlélése rövidebb. Fertőtlenítőszerekre érzékeny. Állatról emberre a fertőzött állat vagy az állati tetem vérével, testváladékával, nyers húsával való direkt kontaktus útján terjed a vírus. Emberről emberre a beteg/holttest vérével, nyálával, vizeletével, székletével, hányadékával, ondójával, anyatejével, egyéb testváladékával, szervével/szövetével való direkt kontaktus útján, illetve ezekkel szennyezett injekciós tűkkel (nozokomiális) vagy éles eszközökkel való felületi sérülés révén, továbbá szennyezett ruhák, ágynemű, egyéb tárgyak, felületek közvetítésével bőr-, nyálkahártya-sérülésen átjutva terjed a kórokozó. (A szennyezett felületek, eszközök útján történő terjedés jelentősége kórházi körülmények között jelentős.) Szexuális érintkezés útján: a vírus az ondóban a gyógyulás után hét hétig jelen lehet. A kórokozó nem terjed szúnyogcsípés révén illetve levegő útján, a járvány által érintett területeken élő, onnan érkező nem-beteg emberekkel történt alkalmi érintkezés, papírpénz ill. pénzérme érintése során vagy uszodában sem.
A betegség hirtelen kezdődik lázzal, prodromális tünetekkel (1-5. nap): fejfájás, izomfájdalom, émelygés, torokfájás, kötőhártya-gyulladás, szívritmuszavar. A 2014. évi nyugat-afrikai járványban gyakori tünet az 5. napot követően jelentkező hányás, vizes hasmenés és hasi fájdalom. Az 5-7. naptól kezdődően makulopapulózus kiütés (főként arcon, nyakon, törzsön, karon), a betegség későbbi szakaszában vérzések jelentkezhetnek (orr, tüdő, tápcsatorna, injekciók helye, sebek). A beteg szövődménymentesen a 6-11. nap között gyógyul. A 6-16. nap között jelentkezhetnek a szövődmények: máj-, veseelégtelenség, vetélés, végül sokszervi elégtelenség alakulhat ki. Késői komplikációk: vírusperzisztálás következtében herezsugorodás, visszatérő hepatitisz, uveitisz, hajhullás. A letalitás a Marburg-vírus esetében 20–25%, az Ebola-vírus szudáni változatánál 50–65%, a zairei változatánál 77–88%. A fülöp-szigeteki majmokból kitenyésztett Reston törzs esetében tünetmentes fertőzéseket észleltek. A napjainkig rendelkezésre álló tudományos ismeretek alapján a lappangási időben az érintett személy nem fertőzőképes. A vér fertőzőképessége valószínűleg a betegség időszakára terjed ki. Az ondó hosszú ideig tartalmazhatja a vírust.
Írásunk az alábbi közlemények alapján készült:
Summary of Opinion (SMOP)– Ervebo (EMA)
Meeting highlights from the Committee for Medicinal Products for Human Use (CHMP) 14-17 October 2019







