Ismét egy influenza elleni tabletta
A BLOCKSTONE fázis III vizsgálatban a preventíven adott Xofluza csaknem a tizedére csökkentette az influenza kialakulásának kockázatát.
- Xofluza - új influenza elleni készítmény
- Az influenzavakcinával szemben támasztott helyes elvárások
- Influenzában adjunk antivirális szert!
- Kétségessé vált az influenzavírus elleni szerek hatásossága
- Élethossziglani védettség az influenzától?
- Bizonyos emberek ellenállóbbak a H7N9 influenza vírussal szemben, mint mások
- Influenza ellen védő enzim
- Flucelvax: sejttenyészet útján készült védőoltás influenza ellen
- Influenza
A Roche június 4-én hozta nyilvánosságra a BLOCKSTONE fázis III klinikai vizsgálat néhány fontosabb eredményét. Ebben a vizsgálatban preventíven adott Xofluza (hatóanyag: baloxavir marboxil, gyógyszerforma: 20 vagy 40 mg-os filmbevonatú tabletta) hatásosságát és biztonságosságát vizsgálták olyan egészséges felnőtteken, akiknek a velük közös háztartásban élő családtagjánál vagy családtagjainál influenza vírusfertőzést diagnosztizáltak. A legfontosabb eredmény, hogy a placebót kapó vizsgálati alanyok 13,6%-ánál alakult ki fertőzés, míg a készítményt profilaktikusan szedőknek mindössze 1,9%-a betegedett meg. Az FDA a Xofluzát 2018. október 24-én engedélyezte 12 éven felüli betegek kezelésére, Japánban pedig már 2018 februárjától a piacon van. A tabletta formájú gyógyszert a tünetek (láz, fájdalom, orrfolyás) megjelenésétől számított 48 órán belül kell bevenni, mindössze egy darabot. A készítményt az FDA a júniusban megítélt Priority Review (elsőbbségi felülvizsgálati eljárás) keretében engedélyezte, azaz a jóváhagyási folyamat a szokásos 10 hónap helyett 6 hónapig tartott. A vizsgálatok szerint a Xofluza az influenzavírus A és B törzsei ellen, illetve a humán fertőzéseket is okozó madárinfluenza-törzsek (pl. a H5N1 és a H7N9) ellen is hatásosnak bizonyult. Európában a Xofluza még nincs engedélyezve. A készítmény globális forgalmazási jogai a Roche Group tulajdonában vannak (az Egyesült Államokban a csoportba tartozó Genentech tulajdonában) Japán és Tajvan kivételével, itt a MAH a szer eredeti fejlesztője, a Shionogi & Co. Ltd. Az új vizsgálati eredményekre alapozva az FDA befogadta a Genentech kiegészítő, profilaktikus indikációra vonatkozó kérelmét, olyan 65 éves vagy idősebb populációban, akiknél asztma, krónikus tüdőbetegség, morbid szintű obezitás vagy szívbetegség áll fenn, azaz akiknél az influenza fertőzés különösen súlyos, akár halálos következményekkel járhat. Az engedély-kiegészítés várható dátuma (PDUFA dátum) 2019. november 4.
A hatóanyagról (baloxavir marboxil)
A baloxavir marboxil (ATC kód: J05AX25) a japán Shionogi Co. és a Roche közös fejlesztésű hatóanyaga, egy prodrug, mely a szervezetben baloxavirré, a tényleges vírusellenes hatású anyaggá hidrolizálódik, hatásmechanizmusa alapvetően eltér az eddig szokásosan alkalmazott szerekétől. Ez egy CAP endonukleáz-gátló – az influenza endonukleáz egy létfontosságú aldoménje a vírus RNS-polimeráz enzimjének. A CAP endonukleáz készíti fel a host pre-mRNS-eket, hogy a vírus mRNS-ek primereiként szolgáljanak, ezen tulajdonsága miatt már korábban is egy gyakran kutatott gyógyszercélpont volt az influenza elleni szerek fejlesztése során. Az endonukleáz aktivitásának gátlása blokkolja az mRNS-transzkripciót, ezzel inaktiválja az influenza vírust.
A Xofluza az első és egyetlen orálisan szedhető egydózisú influenza elleni gyógyszer, és 20 éve az első újféle hatásmechanizmusú szer. Emellett a Xofluza az egyetlen olyan új hatásmechanizmusú influenza elleni készítmény, amely influenzafertőzésnek kitett, egyébként egészséges emberekben (CAPSTONE-1 vizsgálat [NCT02954354]) és az influenza szövődményeinek kitett magas kockázatú betegekben (CAPSTONE-2 vizsgálat [NCT02949011]) is hatásosnak bizonyult.
A BLOCKSTONE vizsgálatról és a korábbi CAPSTONE 2 vizsgálatról
A BLOCKSTONE egy randomizált, placebo-kontrollos, profilaktikus fázis III vizsgálat, mely a Xofluza egyetlen adagjának profilaktikus hatását vizsgálta Japánban, a 2018-2019-es influenzaszezonban olyan embereknél, akik influenza vírussal fertőzött családtaggal laknak egy háztartásban. A fertőzés tényét egy influenza gyorsteszttel igazolták, a betegek pedig két karra randomizálták: egy adag testsúlyhoz igazított dózisú Xofluza ill. placebo. Az elsődleges végpont azon betegek aránya volt, akiknél az influenza teszt pozitív eredményt mutatott illetve lázas állapot alakult ki, és az 1-10. nap közötti időszakban légzőszervi tünetek alakultak ki. Az eredmények szerint a Xofluza jelentős profilaktikus hatást mutatott, mivel a placebót kapó betegek 13,6%-ánál alakult ki fertőzés szemben a készítményt szedő alanyok 1,9%-ával. A mellékhatások incidenciája 22,2% volt a Xofluza és 20,5% a placebo esetében, ám súlyos mellékhatást nem tapasztaltak.
A korábbi fázis III CAPSTONE-2 klinikai vizsgálatban placebóval összehasonlítva a baloxavir-marboxillal kezelt csoportban a tünetek enyhüléséig eltelt idő 73,2 óra volt, míg a placebo csoportban 102,3 óra. A készítményt olyan betegeknél értékelték, akiknél magas a súlyos szövődmények kialakulásának kockázata (65 év feletti életkor, társbetegségek, például asztma, krónikus tüdőbetegség, kóros elhízás vagy szívbetegség jelenléte). A CAPSTONE-2 vizsgálat azt is igazolta, hogy a baloxavir-marboxil hatékony volt az A/H3N2 és B típusú influenzával szemben (csökkentette a fertőzés tüneteinek kialakulásáig eltelt időt (medián időtartam placebóval összehasonlítva 75,4 óra vs 100,4 óra, illetve 74,6 óra vs 100,6 óra). A kutatás emellett alátámasztotta, hogy a baloxavir-marboxil kezelés oseltamivirrel összehasonlítva a teljes betegpopulációban rövidebb idő alatt enyhítette az influenzafertőzés tüneteit (73,2 óra vs 81,0 óra). A B-típusú influenzában szenvedő betegek alpopulációjában a baloxavir-marboxil szignifikánsan hatékonyabb volt a tünetek enyhüléséig eltelt időtartam csökkentésében, mint az oseltamivir (medián időtartam 74,6 óra vs 101,6 óra). A baloxavir-marboxil placebóval és oseltamivirrel összehasonlítva egyaránt hatékonyabbnak bizonyult a másodlagos végpontok tekintetében is, többek között a vírusürítés időtartamának csökkentésében (medián időtartam 48,0 óra vs 96,0 óra). A baloxavir-marboxil kezelés során az antibiotikumok alkalmazása is kisebb mértékű volt, illetve az influenzával összefüggő szövődmények incidenciája is alacsonyabb volt, mint a placebo-csoportban (3,4% és 2,8% vs 7,5% és 10,4%). A baloxavir-marboxil csoportban a nemkívánatos események gyakorisága szintén alacsonyabb volt (25,1%), mint a placebo-csoportban (29,7%) vagy az oseltamivir-csoportban (28,0%) észlelt.
Tavaly az FDA a Xofluzát a készítményt két klinikai vizsgálat adatai alapján engedélyezte, melyekbe összesen 1832 beteget vontak be. Mindkét vizsgálatban sokkal gyorsabban épültek fel a Xofluzával kezeltek, mint a placebót kapó betegek, illetve az egyik vizsgálat eredményei nem mutattak ki jelentős különbséget a Tamiflu és a Xofluza hatásossága között. A szer alkalmazása során jelentett leggyakoribb mellékhatások a hasmenés és a bronchitis voltak. További vizsgálatok szükségesen annak megállapítására, hogy a készítmény biztonságosan használható-e gyerekek körében (12 év alatti gyerekeknél a szer nincs engedélyezve), illetve, hogy a szer elterjedt használata valóban csökkenti-e a hospitalizációs és halálozási rátát.
A 2018/19-es magyarországi influenza szezon, figyelőszolgálati adatok
Hazánkban a Nemzeti Népegészségügyi Központ Járványügyi és Infekciókontroll Főosztálya időszakos influenza figyelőhálózatot üzemeltet, mely folyamatosan szolgáltat adatokat a betegek számáról. A 2019. év 20. hete, azaz a május 13-19. közötti időszak volt az utolsó hét, amikor a figyelőszolgálatra felkért orvosok a 2018/2019-es influenza szezonban jelentették az influenzaszerű tünetek miatt orvoshoz fordulók számát.
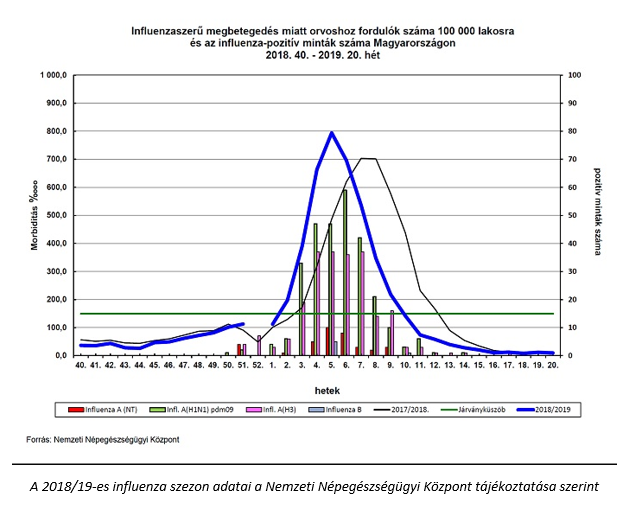
A jelentések alapján végzett becslés szerint az országban 2019. május 13‑19. között 950 beteg fordult orvoshoz influenzaszerű tünetekkel. A betegek 7,5%-a gyermek, 59,2%-a 15-34 éves fiatal felnőtt volt. A 35-59 évesek korcsoportjába tartozott a betegek 20,9%-a, 12,4%-uk pedig a 60 éven felüliek közül került ki. A 20. naptári héten az NNK Légúti vírus osztályára négy hagyományos, diagnosztikus célú légúti minta érkezett influenza-gyanús betegtől. Az elvégzett virológiai vizsgálatok influenzavírus jelenlétét egyik mintában sem igazolták. Influenzaszerű megbetegedések halmozódásáról a 20. héten nem érkezett jelentés.
Összegzés: Az influenzaszerű megbetegedéssel orvoshoz fordulók száma a 20. héten 950 fő, a becsült morbiditás 9,6%ooo volt. Influenzavírus által okozott megbetegedést nem diagnosztizáltak, nincs influenza-aktivitás.
A 2018. év 40. és 2019. év 20. hete között 1 306 betegtől származó vizsgálati anyagot dolgoztak fel a Nemzeti Népegészségügyi Központ Légúti vírus osztályán, ahol 545 főnél igazoltak influenza A [283 influenza A(H1N1)pdm09, 226 influenza A(H3N2), 36A(NT)] és 6 influenza B vírus okozta fertőzést. Száztizenhárom főnél légúti óriássejtes vírus, harminchárom betegnél pedig adenovírus kóroki szerepét igazolták.
Az Egészségügyi Világszervezet és az Európai Gyógyszerügynökség bizottsága a 2018/2019. évi influenzaszezonra a trivalens influenza elleni vakcina előállításához az északi féltekén
- A/Michigan/45/2015 (H1N1)pdm09-szerű;
- A/Singapore/INFIMH-16-0019/2016 (H3N2)-szerű;
- B/Colorado/06/2017-szerű influenza vírustörzseket ajánlja.
Az előző szezonhoz képest az oltóanyagban WHO ajánlásra változott a H3N2 altípusú influenza A és az influenza B vírus törzs. A kórokozó változékonysága miatt minden évben új oltóanyagot állítanak elő és a megfelelő védelem érdekében évenkénti oltásra van szükség. Az oltóanyagok élő vírust nem tartalmaznak, ezért az oltás következményeként influenza fertőzés/megbetegedés nem alakulhat ki. Az oltást követő esetleges légúti betegség véletlen egybeesés következménye, és más légúti kórokozó válthatja ki. Oltás után ritkán észlelnek enyhe reakciót, mellékhatást (láz, fejfájás, bőrpír, duzzanat), ami 1-2 nap alatt elmúlik.
Írásunk az alábbi közlemények alapján készült:
Genentech : Late-stage Study Shows Xofluza Prevents Influenza Infection (Markets Insider)
Az influenzafertőzéssel kapcsolatos legújabb kutatási eredmények
Tájékoztató az influenza figyelőszolgálat adatairól - 2019.20. hét







