Az első nem tüneti kezelés Alzheimer-kór ellen
Az FDA 2003 óta először engedélyezett új Alzheimer-kór kezelésére alkalmas készítményt (Aduhelm, adukanumab), mely első gyógyszerként a betegség elleni küzdelemben nem tüneti kezelést nyújt, hanem a betegség egyik alapvető okát kezeli.
- Új Alzheimer-kór elleni antitest a láthatáron
- Amerikában már engedélyezés alatt az adukanumab
- Aducanumab korai Alzheimer-kórban
- Immunrendszert erősítő antitestet vizsgálnak az Alzheimer-kór kezelésében
- Noninvazív audiovizuális terápiás eszköz az Alzheimer-kór kezelésében
- Kisérleti szer hatásossága korai Alzheimer-kórban
- Gyógyszeradagoló tapasz Alzheimer-kórra
- Jótékony fénykezelés Alzheimer-kórban
- Új kismolekulás Alzheimer elleni szer a láthatáron
- A korai Alzheimer-kór jelei a retinán
- Nőkben jóval gyakoribb az Alzheimer kór
Az FDA június 7-én engedélyezte az Alzheimer-kór kezelésére javallott Aduhelm (adukanumab) injekciót (kérelmező: Biogen és Eisai Co., Ltd.) A biológiai készítmény az első és egyetlen olyan szer, mely a betegségben szenvedőknél az egyik leginkább meghatározó kórképet, az amiloid-béta plakkokat kezeli, számukat csökkenti, terjedésüket gátolja. Az FDA az Aduhelmet a klinikai vizsgálati program eredményei alapján úgynevezett gyorsított engedélyezési eljárás (accelerated approval) keretében hagyta jóvá, ami azt jelenti, hogy a hatóság véleménye szerint okszerűnek tekinthető, hogy a szer klinikai előnyt okoz a szellemi hanyatlás lassításával. Fontos, hogy egy vizsgálati végpont szerint az amiloid plakkok mennyiségének csökkenése bizonyítottnak tekinthető ugyan, viszont az még csak egy erős indokokkal alátámasztható feltevés, hogy az Aduhelm valóban lassítja vagy megakadályozza, esetleg visszafordítja a kognitív hanyatlást.
Ezért a végleges engedélyhez a kérelmezőknek további megerősítő vizsgálatok (confirmatory trials) elvégzését írta elő az FDA (ezeket nevezik néha jóváhagyást követő [post-approval] vagy fázis IV vizsgálatoknak is). Az amerikai szaksajtó túlnyomó többsége az igen sokszor vitatott eredmények ellenére is történelmi jelentőségűnek minősíti az engedély kiadását, tekintettel egyrészt arra, hogy 2003 óta ez az első, Alzheimer-kór kezelésére szolgáló jóváhagyott készítmény, másrészt ez már nem tüneti kezelés. Csak az Egyesült Államokban 5,7-6 millió beteget kezelnek Alzheimer-kórral, mely óriási terhet ró a gondozókra és a családokra (becslések szerint körülbelül évi 200 milliárd dollár csak a kezelési költség, és itt a hozzátartozók életminőség-romlásáról még nem is beszéltünk). Ha viszont a fázis IV vizsgálatok nem szolgálnak kellő megerősítéssel, a kérelmező vállalatnak vissza kell vonni a piacról a készítményt.
A hatóanyagról (adukanumab) és a klinikai vizsgálati programról
Az adukanumab (aducanumab) egy humán monoklonális antitest, amelyet kifejezetten az agyban keletkező amiloid-béta plakkok mennyiségének csökkentésére fejlesztettek ki. A hatóanyagot eredetileg a Neurimmune fedezte fel, majd a Biogen szerezte meg a licencét, 2017-től pedig a Biogen és az Eisai együttműködésben dolgozik a szer fejlesztésén és piacra dobásán. Az adukanumab hatásmechanizmusáról és a klinikai vizsgálati programról részletesebben korábbi cikkeinkben számoltunk be: Aducanumab korai Alzheimer-kórban, Új Alzheimer-kór elleni antitest a láthatáron és Amerikában már engedélyezés alatt az adukanumab.
Az Alzheimer-kórról bővebben
Az Alzheimer-kór heterogenitásáról és diagnosztikájáról korábbi cikkünkben számoltunk be: Az Alzheimer-kór heterogenitása (szerző: Dr. Kovács Tibor). A demens betegek hazai kezelési gyakorlatáról pedig alábbi cikkeinkben írtunk: Új kismolekulás Alzheimer elleni szer a láthatáron, Gyógyszeradagoló tapasz Alzheimer-kórra.
Gyógyszerpiaci kitekintés, a készítmény ára
Az amerikai szaksajtó néha már-már bulváros nyelvezete szerint a Biogen számára élet-halál kérdése volt az Aduhelm engedélyezése, több cikkben is a pókerből ismert „all-in” kifejezést használták az készítménnyel kapcsolatban, tükrözve, hogy a cég mindent egy lapra tett fel. Tény, hogy tavaly elért 13,4 milliárd dolláros árbevételük 6%-kal volt kevesebb az előző évinél, a 2021-es forgalmukat pedig a 10,5-10,8 milliárd dollár közötti tartományba becsülik a vállalat saját előrejelzései. 2020 két évtized után az első olyan év volt, melyben a Biogen árbevétele csökkent, és minden bizonnyal ezt követi a következő. A visszaesés oka elsősorban a generikumok színre lépése több fontos piacon: a cég árbevételének 40%-át adó Tecfidera (sclerosis multiplex indikáció) 2020 utolsó negyedévében 608 millió dolláros bevételt hozott, ami 50%-kal kevesebb, mint 2019 hasonló időszakában. Másik jelentős szerük, a Spinraza (SMA) forgalma is csökkent 8%-kal, de itt ijedelemre inkább az adhat okot, hogy az Egyesült Államokban ez a visszaesés 34%-os volt. Kétségtelen, hogy a vállalatra a befektetők és részvényesek részéről erős nyomás helyezedik, ám 33 klinikai fejlesztési programjuk közül 10 már késői fázisban tart, és folyamatosan vásárolnak új hatóanyagokat, készítményeket, ami reménykeltő.
Valószínűleg ennek a nyomásnak is köszönhető, hogy a Biogen még az ágazati elemzőket is meglepte az Aduhelm listaárával, amely többszöröse lett a szakma által előre jósoltnál: egy átlagos beteg éves kezelésének költsége 56 ezer dollár körül lesz (egy átlagos testtömegű betegnél alkalmazott egyetlen infúzió ára 4312 dollár). Az eltérő keresetek és gyógyszer-ártámogatási rendszerek miatt ugyan nincs ugyan sok értelme ennek az összehasonlításnak, de ez jó magyar forintra átszámolva majdnem 16 millió forint. Az Institute for Clinical and Economic Review előzetesen még 8300 dollárra becsülte a készítmény éves listaárát.
Az elemzők ilyen ár mellett módosították modelljeiket, és a Bernstein szakértői például 10 milliárd dollár körüli éves forgalmat jósolnak a készítménynek a termékciklus legjobb éveiben. A Cantor Fitzgerald modelljei szerint a csúcs eladásokat 2028-ra éri el az Aduhelm, bár ők egy kicsit alacsonyabbra, 8,2 milliárd dollárra lövik be az éves forgalmat. Mint a fentiekben írtuk, ez körülbelül annyi, mint a cég teljes idei árbevétele tokkal-vonóval, az összes jelenlegi gyógyszerüket beleszámítva. Az FDA engedély bejelentésének piaci jelentőségét érzékelteti, hogy a hétfői napra időzített bejelentés miatt a Biogen részvényeinek adásvételét felfüggesztették, a kereskedés újraindítását követően pedig az árfolyam egyetlen nap alatt 54%-kal, 434 dollárra ugrott fel.
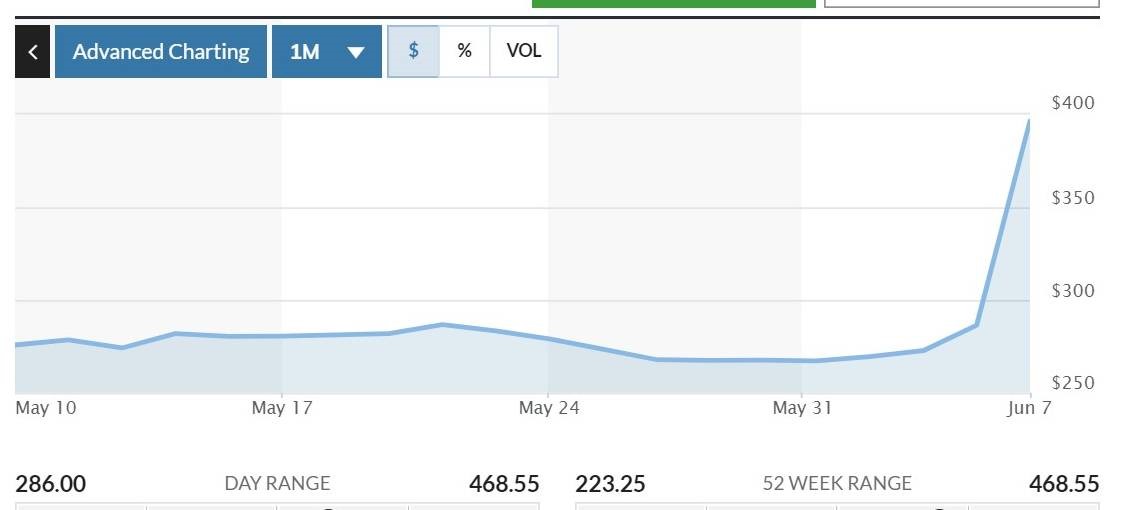
A Biogen részvényárfolyamának keddi emelkedése az Aduhelm engedélyének kiadásakor
Az elemzők korábban egyáltalán nem gondoltak arra, hogy ekkora blockbuster lehet a készítmény, jócskán meg kellett emelni az előrejelzések számait. Ennek legfőbb oka az, hogy az Aduhelm meglepően széles indikációs kört kapott a hatóságtól: bár a készítményt (főleg elővigyázatosságból) a betegség korai stádiumában vizsgálták, és korábban egy szakértői panel már el is utasította a szert, az FDA némileg meglepő módon az összes Alzheimer-kórban szenvedő beteg kezelésére engedélyezte a készítményt. Az adukanumab klinikai vizsgálati eredményei némiképp ellentmondásosak voltak, ezért sok szakíró az engedélyezés valószínűségét a pénzfeldobáséhoz hasonlította, arra pedig csak nagyon kevesen gondoltak, hogy teljes jóváhagyást kap, még ha ehhez megerősítő vizsgálatok lefolytatását írják is elő. Ez azt jelenti, hogy az Aduhelm elméletileg a 6 millió amerikai beteg mindegyikénél javallattal rendelkezik, és pillanatnyilag egyeduralkodó ezen a piacon.
Írásunk az alábbi közlemények alapján készült:
Update on FDA Advisory Committee’s Meeting on Aducanumab in Alzheimer’s Disease
Biogen's aducanumab crosses FDA finish line just in time to save its business
Biogen's 'shockingly broad' Aduhelm label—and $56K price—set up a $10B launch, analysts say